
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 4. Химическая кинетикаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Химическая кинетика – это наука, изучающая механизм и закономерности протекания химических процессов во времени. Химическая кинетика рассматривает и устанавливает зависимость скорости химических реакций от концентрации реагентов и температуры, от условий проведения реакций. Так, например, химическая кинетика рассматривает влияние катализатора на механизм и скорость протекания химических реакций. Химическая кинетика устанавливает связь между строением химических соединений и их реакционной способностью. Химическая кинетика, как и химическая термодинамика, является теоретической основой химической технологии. Однако термодинамика сама по себе не в состоянии определить за какое время может быть достигнут ожидаемый результат, так как важнейшая для практики величина - время - выпадает из обычного термодинамического рассмотрения. Химическая кинетика представляет не только научный интерес, но имеет и большое практическое значение. Химическая кинетика позволяет рассчитать не только время достижения заданной степени превращения исходных веществ, но и найти условия, при которых это время будет минимальным и выбрать наиболее эффективные факторы воздействия на скорость протекания реакции, то есть она открывает возможность сознательного управления промышленными процессами, позволяет решать вопросы интенсификации технологических процессов. Только с учетом законов химической кинетики могут быть созданы новые технологические процессы, рассчитаны оптимальные условия проведения реакций и эффективные конструкции реакторов. Основные понятия химической кинетики Химическая реакция (химический процесс) состоит в превращении одного или нескольких химических веществ, называемых исходными веществами, в одно или несколько других химических веществ, называемых продуктами реакции. Химические превращения, происходящие в ходе реакции, представляют собой очень сложный процесс, при котором изменяется природа отдельных частиц и их межмолекулярные связи. В большинстве случаев химический процесс происходит не путем прямого превращения исходных веществ в продукты реакции, а состоит из нескольких стадий. Каждую из этих стадий можно рассматривать как самостоятельную химическую реакцию со своими исходными веществами и продуктами. Элементарная стадия является наиболее простой составной частью сложного химического процесса и представляет собой совокупность большого числа однотипных элементарных актов непосредственного превращения одной или взаимодействия нескольких частиц. Теоретически все элементарные стадии являются двусторонними (обратимыми), то есть состоят из двух взаимно противоположных элементарных реакций, которые одновременно протекают в прямом и обратном направлении. Однако в большом числе случаев равновесие оказывается сильно смещенным в ту или иную сторону. Если равновесие сильно смещено в сторону образования исходных веществ, то можно считать, что реакция образования продуктов реакции практически не протекает. Если же равновесие сильно смещено в сторону образования продуктов реакции, то процесс считается необратимым (односторонним) и обратной реакцией при этом можно пренебречь. Такие реакции называются односторонними или необратимыми. Элементарные акты химического превращения могут быть весьма разнообразны. Это может быть внутримолекулярная перегруппировка какой либо одной молекулы или распад молекулы на несколько частиц, например, распад хлористого этилена на этилен и хлористый водород:
или взаимодействие двух и более частиц, например:
Совокупность и последовательность элементарных стадий, из которых складывается реакция, называется механизмом или схемой химической реакции. Простая реакция – это реакция, состоящая из одних и тех же элементарных стадий. Сложная реакция – это реакция, которая состоит (складывается) из нескольких разнотипных элементарных стадий. Характерной особенностью большого числа сложных химических реакций является образование на некоторых стадиях частиц, расходующихся затем в других стадиях. Такие частицы называются промежуточными частицами, а реакции образования и расходования этих частиц – промежуточными реакциями. Промежуточными частицами могут быть неустойчивые молекулы и ионы, свободные радикалы, ион-радикалы. Радикалы это частицы, обладающие не спаренными электронами. Элементарная стадия состоит из суммы актов химического превращения одной или нескольких частиц. Для того чтобы произошел акт химического превращения, реагирующие частицы должны сблизиться. При сближении двух или нескольких частиц происходит постепенная перестройка связей между атомами – одни связи ослабевают и разрываются, а другие образуются. При этом из исходных веществ получаются продукты реакции. Для возникновения новых связей «старые» связи в исходных молекулах должны или разорваться или в значительной степени ослабнуть. Для этого требуется существенное увеличение внутренней энергии реагирующих молекул, поэтому вступать в химическое взаимодействие могут только молекулы, обладающие необходимым избытком энергии, так называемые «активные молекулы». При протекании химической реакции в исходном состоянии вещества обладают одним запасом энергии, а в конечном – другим. В ходе химического превращения достигается некоторое промежуточное состояние, называемое переходным состоянием, когда одни связи ослабли, но еще не разорвались, а новые связи только образуются. Это промежуточное состояние называется активированным комплексом. Для образования активированного комплекса необходимо затратить энергию. То есть для того, чтобы совершился элементарный химический акт, молекулы должны преодолеть некоторый энергетический барьер, высота которого определяется природой реагирующих частиц. Таким образом, активированный комплекс находится в состоянии непрерывного образования и разрушения в процессе перехода через потенциальный барьер.
Рис.1. Схематическое изображение элементарной стадии химической реакции: а) – эндотермическая реакция; б) – экзотермическая реакция. Е 1 и Е 2 – энергия активации прямого и обратного процессов; D Н – тепловой эффект химической реакции. Превышение средней энергии активированного комплекса над средней энергией исходных веществ или продуктов реакции при данной температуре называется энергией активации прямого или обратного процесса. Таким образом, элементарная стадия реакции – это акт химического превращения одной или нескольких частиц, при протекании которого преодолевается один и только один энергетический барьер. В зависимости от числа частиц участвующих в элементарном акте, говорят о молекулярности элементарной стадии или молекулярности реакции. Молекулярность – число частиц, участвующих в одном элементарном акте химической реакции. Если в элементарном акте участвует одна частица, то молекулярность равна единице и такую элементарную стадию называют мономолекулярной. Если в элементарном акте участвует две частицы, то молекулярность равна двум и такую элементарную стадию называют бимолекулярной, если участвуют три частицы, то молекулярность равна трем и реакция называется тримолекулярной. Тримолекулярные реакции встречаются редко, а четырехмолекулярные стадии не встречаются вообще, т. к. одновременная встреча четырех частиц – событие практически невероятное. Физико-химические процессы могут протекать в системах, состоящих из одной или нескольких фаз. Химические реакции, протекающие в пределах одной фазы, называется гомогенными. Реакционным пространством, т. е. пространством, в котором протекает реакция, в этом случае является объем. Химические реакции, протекающие на границе раздела фаз, называются гетерогенными. В этом случае реакционным пространством будет поверхность раздела фаз. Различают гомофазные и гетерофазные химические реакции. Гомофазными называют реакции, в которых исходные, промежуточные и конечные вещества находятся в одной фазе. Гетерофазными называются реакции, компоненты которых находятся в разных фазах. Например, реакция
является гомогенной гетерофазной реакцией, так как протекает в объеме газа, но исходные вещества и продукты реакции находятся в разных фазах. Реакция гашения извести
относится к гетерогенным гетерофазным реакциям, так как компоненты находятся в разных фазах и процесс идет на границе раздела жидкости и твердого оксида кальция. Скорость химической реакции Важнейшей количественной кинетической характеристикой химической реакции является ее скорость.Существует несколько понятий, определяющих скорость химических превращений. 1. Скоростью образования i-го компонента (скорость химической реакции по i-му веществу) (ri) называется изменение количества этого вещества (числа молекул или количества молей) в единицу времени в единице реакционного пространства:
где R –величина реакционного пространства, Количество вещества, реагирующего в единицу времени, всегда пропорционально величине реакционного пространства. Поэтому скорость относят к единице реакционного пространства. Изменение количества вещества в реакционном пространстве может быть обусловлено как протеканием реакции, так и обменом веществом с окружающей средой. Поэтому следует отдельно рассматривать открытые и закрытые системы.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 799; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |


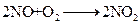 .
.


 , (4.1)
, (4.1) - изменение количества молей i -гокомпонента. Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем (R ≡ V). Если реакция гетерогенная и протекает на границе фаз, то реакционным пространством является поверхность (R ≡ S).
- изменение количества молей i -гокомпонента. Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем (R ≡ V). Если реакция гетерогенная и протекает на границе фаз, то реакционным пространством является поверхность (R ≡ S).


