
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика цепных реакций с разветвленными цепямиСодержание книги
Поиск на нашем сайте
Если в результате одного элементарного акта регенерируются две или больше активных частиц, то происходит цепная реакция с разветвленными цепями. Примером такого процесса цепной реакции с разветвленными цепями может служить реакция окисления водорода кислородом. В этой цепной реакции, наряду с образующимися радикалами В простейшем виде реакцию горения водорода в кислороде можно представить в виде схемы: 1. 2. 3. 4. 5. 6.
Образовавшиеся активные частицы в результате разветвленной цепной реакции вызывают превращение большой массы исходных веществ в конечные продукты, что может привести к взрыву или воспламенению (первый и второй пределы воспламенения). Предел воспламенения означает переход от стационарного процесса к взрывному. Для регулирования скорости и торможения разветвленных цепных реакций в реакционную смесь добавляют вещества, называемые замедлителями, или ингибиторами. Обрывая цепь, они уменьшают скорость процесса. Так ведет себя, например, тетраэтилсвинец, прибавляемый в небольших количествах к авиационным и автомобильным бензинам. Переходя вместе с бензином в парообразное состояние в камере двигателя, тетраэтилсвинец обрывает цепь при горении топлива. При хранении мономеров часто добавляют ингибиторы, чтобы предотвратить цепную реакцию самопроизвольной полимеризации. Рассмотрим элементарную вероятностную теорию цепных реакций. Скорость цепной реакции
где n 0 - число активных частиц зарождающихся в 1 сек, которое равно числу зарождающихся цепей в 1 сек.;
Подставляя (6.9) в (6.8), можно рассчитать скорость неразветвленной цепной реакции:
Теория обрыва цепей на стенках реакционного сосуда разработана Н.Н. Семеновым. Различают диффузионную и кинетическую области протекания реакции обрыва. В кинетической области скорость обрыва зависит от скорости взаимодействия свободных радикалов или атомов со стенкой; она пропорциональна отношению площади поверхности сосуда к его объему (
где D – коэффициент диффузии; d – диаметр реакционного сосуда; В диффузионной области протекания реакции обрыва, то есть при малых значениях D и при выполнении условия
В кинетической области протекания реакции обрыва цепей, то есть при выполнении условия
В присутствии посторонних примесей вероятность обрыва цепи
Подставляя (4.184) в (4.180), получим:
Если
Например, присутствие в реакционной смеси кислорода уменьшает во много раз скорость реакции образования хлористого водорода. Для цепных реакций с разветвленными цепями, кроме вероятности обрыва цепей, необходимо также учитывать вероятность разветвления цепей. Обозначим
Если обрывы преобладают над разветвлениями, то Если вероятность разветвления Когда Н.Н. Семенов показал, что для описания кинетики разветвленных цепных реакций можно применить принцип частично-стационарных концентраций: концентрации всех активных частиц, обладающих высокой реакционной способностью, можно считать квазистационарными, кроме той активной частицы, чья концентрация существенно возрастает в ходе реакции. Применяя этот принцип к реакции горения водорода в кислороде, описанному выше, можно считать, что
Это позволяет заменить часть дифференциальных уравнений на алгебраические и получить кинетические выражения, объясняющие опытные данные, а именно, причины появления первого и второго пределов воспламенения.
Примеры решения задач. Пример 1. Реакция образования фосгена
протекает по механизму неразветвленной цепной реакции. Экспериментально определенное значение скорости образования фосгена равно:
Показать, что истинный механизм процесса может быть представлен схемой: 1. 2. 3. 4. 5.
Решение. Фосген образуется на стадии 3. Скорость его образования равна:
Для оценки концентрации промежуточных частиц Запишем скорости образования этих частиц и приравняем их к нулю.
Если сложить уравнения (3) и (4), то получим:
Найдем концентрацию частиц
Подставим полученное значение концентрацию частиц
Найдем концентрацию частиц
Подставим уравнение (8) в уравнение (2)
Уравнение (9) совпадает с эмпирическим уравнением (1) при условии, что
Допущение Пример 2. Одним из примеров цепной реакции является пиролиз диметилсульфоксида – CH3SOCH3. Кинетика этой реакции изучалась путем измерения скорости образования метана. Экспериментально установлено, что реакция имеет первый порядок, опытное значение энергии активации равно 11,5 кДж/моль. Для описания процесса разложения предложен следующий механизм протекания элементарных стадий процесса:
Энергии активации элементарных стадий соответственно равны: Е 1 =16 кДж/моль; Е 2 =2,4 кДж/моль; Е 3 =4,8 кДж/моль; Е 1 ~0 кДж/моль. Применив принцип квазистационарных концентраций, и полагая, что скорость обрыва цепи (4) существенно меньше скорости ее продолжения (3), покажите, что эта схема согласуется с экспериментальными кинетическими результатами. Решение. 1. Так как кинетика данной химической реакции исследовалась путем измерения 2. скорости образования метана, то проведем оценку порядка данной химической реакции по метану. Согласно приведенной кинетической схеме метан образуется по реакции (2). Скорость его образования равна:
Для решения задачи необходимо знать концентрацию радикала
Если сложить уравнения (6) и (7), то получим, что v 1 = 2 v4, то есть
откуда
Из уравнения (7), учитывая, что
Таким образом, скорость образования метана равна:
или
Откуда
Подставив (13) в (5) получим искомое уравнение для скорости образования метана:
Из уравнения (14) видно, что скорость реакции имеет первый порядок по исходному веществу, что соответствует опытным данным. 2. Рассчитаем энергию активации процесса. Из уравнения (14) видно, что значение опытной константы скорости связано с константами скоростей элементарных стадий соотношением:
Каждая из констант скоростей элементарных стадий связана с энергией активации процесса соотношением:
Из сравнения уравнений (15) и (16) можно получить значение опытной энергии активации всего процесса:
Полученное значение хорошо согласуется с энергией активации, определенной из опыта 11,5 кДж/моль.
Вопросы и задания для самоконтроля. 1. За счет каких процессов возможно образование свободных радикалов при протекании цепной реакции? 2. Приведите формулу для определения длины цепи. От каких факторов зависит длина цепи в случае неразветвленных и в случае разветвленных цепных реакций? 3. Перечислите название стадии цепной реакции: 1) 4) 4. Чему равна скорость цепной реакции в случае стационарного режима ее протекания? 5. Покажите, какой вид приобретает уравнение константы скорости реакции обрыва цепи, если эта реакция протекает а) в диффузионной области; б) в кинетической области. 6. Как связаны длина цепи и вероятность ее обрыва?
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 640; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.241.87 (0.007 с.) |

 и Н, обеспечивающими развитие неразветвленной цепи, возникает атом кислорода, имеющий две свободные валентности.
и Н, обеспечивающими развитие неразветвленной цепи, возникает атом кислорода, имеющий две свободные валентности. зарождение цепи
зарождение цепи продолжение цепи
продолжение цепи разветвление цепи
разветвление цепи разветвление цепи
разветвление цепи гетерогенный обрыв (первый предел)
гетерогенный обрыв (первый предел) гомогенный обрыв (второй предел)
гомогенный обрыв (второй предел) равна числу молекул продукта реакции, образующихся за 1 сек. и может быть выражена уравнением:
равна числу молекул продукта реакции, образующихся за 1 сек. и может быть выражена уравнением: , (4.178)
, (4.178) – средняя длина цепи, равная числу ее звеньев. Обозначим через
– средняя длина цепи, равная числу ее звеньев. Обозначим через 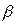 вероятность обрыва цепи, которую можно определить по соотношению:
вероятность обрыва цепи, которую можно определить по соотношению: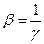 . (4.179)
. (4.179) . (4.180)
. (4.180) ), а также зависит от величины
), а также зависит от величины  – вероятности захвата стенкой свободных радикалов (
– вероятности захвата стенкой свободных радикалов ( , (4.181)
, (4.181) – средняя арифметическая скорость процесса.
– средняя арифметическая скорость процесса. >>
>>  , константа скорости обрыва цепи равна:
, константа скорости обрыва цепи равна: . (4.182)
. (4.182) . (4.183)
. (4.183) . (4.184)
. (4.184) . (4.185)
. (4.185) >>
>>  , то уравнение (4.185) примет вид:
, то уравнение (4.185) примет вид: . (4.186)
. (4.186) вероятность разветвления цепи на данном звене. Тогда вероятность обрыва цепи уменьшится и станет равной
вероятность разветвления цепи на данном звене. Тогда вероятность обрыва цепи уменьшится и станет равной  . (4.187)
. (4.187) >>
>>  , то реакция идет стационарно, как и в случае неразветвленных цепей.
, то реакция идет стационарно, как и в случае неразветвленных цепей.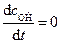 ;
;  ;
;  .
.
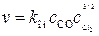 . (1)
. (1) ,
, ,
,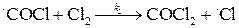 ,
, ,
, .
.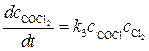 (2)
(2) и
и  , применим принцип стационарных концентраций Боденштейна.
, применим принцип стационарных концентраций Боденштейна. ; (3)
; (3) . (4)
. (4) ;
;  . (5)
. (5) (6)
(6) (7)
(7) (8)
(8) . (9)
. (9) >>
>>  :
: . (10)
. (10) ; (1)
; (1) ; (2)
; (2) ; (3)
; (3) . (4)
. (4) . (5)
. (5) . Для нахождения этой величины воспользуемся принципом квазистационарных концентраций Боденштейна:
. Для нахождения этой величины воспользуемся принципом квазистационарных концентраций Боденштейна: ; (6)
; (6) . (7)
. (7) , (8)
, (8) (9)
(9) >>
>>  , находим:
, находим: . (10)
. (10)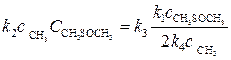 , (11)
, (11) (12)
(12) (13)
(13)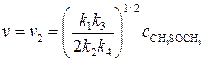 (14)
(14) (15)
(15) , (16)
, (16) = ½(16 + 4,8 + 2,4 – 0) = 11,6 кДж/моль.
= ½(16 + 4,8 + 2,4 – 0) = 11,6 кДж/моль.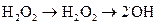 ; 2)
; 2)  ; 3)
; 3) 
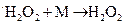 ; 5)
; 5)  .Эта реакция относится к разветвленным или не разветвленным цепным реакциям?
.Эта реакция относится к разветвленным или не разветвленным цепным реакциям?


