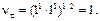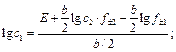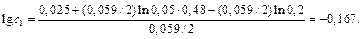Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванические элементы и их ЭДССодержание книги
Поиск на нашем сайте Из двух электродов может быть составлена электрохимическая цепь — гальванический элемент, в которой электрическая энергия вырабатывается за счет протекания электрохимических реакций на электродах. Перенос заряда через границу раздела фаз (электрический ток) в такой системе осуществляется за счет электрохимической реакции, протекающей самопроизвольно. Электрод, на котором происходит электровосстановление, называется катодом, а электрод, на котором происходит электроокисление, называется анодом. Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Основной электрической характеристикой электрохимической цепи является разность электрических потенциалов между электродами. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока. Правильно разомкнутая электрохимическая цепь, на концах которой можно измерить электрическую разность потенциалов, всегда должна заканчиваться одинаковыми по своему химическому составу металлами. Обычно это достигается простым подключением к металлам М1 и М2 медных проводов. Включение между двумя металлическими проводниками третьего металлического проводника, согласно закону Вольта, не изменяет разности потенциалов на концах цепи. Электрохимическая цепь является равновесной при условии, что электрохимическое равновесие наблюдается на каждой фазовой границе, а разность потенциалов на концах цепи Е скомпенсирована разностью потенциалов от внешнего источника тока. При схематической записи электрохимической цепи: 1. Левый электрод записывается в обратном порядке (вещества, находящиеся в растворе, указываются справа от вертикальной черты, слева указываются вещества, образующие другую фазу, или материал электрода). Правый электрод записывается в обычном порядке согласно правилам схематической записи электродов; 2. Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом (диффузионный потенциал не устранен) или двумя пунктирными вертикальными линиями, если диффузионный потенциал между растворами устранен (например, с помощью солевого мостика). В правильно разомкнутой цепи на концах условной записи элемента записывается один и тот же по природе металл. Для простоты часто в записи цепи его опускают. Cогласно правилу записи электродной реакции, окисленная форма вещества и электроны записываются слева. Суммарная реакция, протекающая в элементе, является разницей между реакциями на правом и левом электродах. Тогда, если разность потенциалов всего элемента положительна, то суммарная реакция и электрический ток в гальваническом элементе протекает слева направо, если же отрицательно, то – в обратном направлении. Учитывая, что на катоде происходим электровосстановление, а на аноде – электроокисление, то в гальваническом элементе (при протекании самопроизвольных процессов) катод будет более электроположительным электродом, а анод более электроотрицательным. Если же элемент подключить к внешнему источнику тока и вызвать вынужденные электрохимические процессы (электролиз), то катодом будет более электроотрицательным электродом, а анод – более электроположительным. Во избежание путаницы термины катод и анод чаще употребляют при рассмотрении электролиза, а при рассмотрении гальванических элементов белее употребляют термины «плюс» и «минус» для обозначения катода и анода, соответственно. Рассмотрим в качестве примера три случая. 1. Оба электрода имеют общий раствор: Pt, H2(г) | HCl(aq) | AgCl | Ag На электродах протекают реакции: (1) AgCl + e (2) 2H+(aq) + 2 e Суммарная реакция, протекающая в элементе AgCl + 0.5H2(г) Если ЭДС этого элемента положительна, то суммарная реакция будет протекать в прямом направлении, правый электрод будет более положительным – плюсом (катодом), а левый электрод – более отрицательным – минусом (анодом). 2. Растворы электродов различны и имеют контакт между собой через мембрану (диффузионный потенциал не устранен); Cd | Cd(NO3)2(aq) ¦ NaCl(aq) | AgCl | Ag На электродах протекают реакции: (1) AgCl + e– (2) Cd2+(aq) + 2 e Суммарная реакция, формально протекающая в элементе AgCl + 1/2Cd 3. Растворы электродов различны и соединены между собой солевым мостиком (диффузионный потенциал устранен). Pt | H2(г) | HCl(aq) || NaCl(aq) | AgCl | Ag На электродах протекают реакции: (1) AgCl + e (2) 2H+(aq) + 2 e– Суммарная реакция, формально протекающая в элементе AgCl + 1/2H2(г) Предельное значение разности электрических потенциалов при токе через элемент, стремящемся к нулю, называется электродвижущей силой (ЭДС) и обозначается E. ЭДС гальванического элемента складывается из скачков потенциала на границе всех фаз образующих элемент (рис.4). Разность потенциалов на концах этой цепи складывается из трех гальвани-потенциалов:
В общем виде в формировании ЭДС гальванического элемента участвуют не только скачки потенциалов между фазами электродов, но и разница потенциалов между металлами образующими электронопроводящую фазу электродов – так называемый контактный потенциал, а также разница потенциалов между фазами растворов электродов – диффузионный потенциал.
Рис. 4. Гальванический элемент, составленный из водородного и хлоридсеребряного электродов.
Диффузионный потенциал возникает на границе двух растворов из-за различных подвижностей ионов, содержащихся в электродных растворах и/или их концентраций. Гальванический элемент может иметь общий раствор электролита для обоих электродов. В этом случае диффузионный потенциал будет отсутствовать. В других случаях при проведении электрохимических измерений от диффузионного потенциала стараются по возможности избавиться. Существует несколько способов устранения диффузионного потенциала. Наиболее простым является использование для соединения растворов двух электродов солевого мостика, заполненного раствором соли, катионы и анионы которой обладают приблизительно одинаковыми подвижностями (KCl, KNO3). Контактный потенциал возникает в случае, когда электронопроводящие фазы электродов выполнены из различных металлов. В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения гальвани-потенциалов на границе раздела фаз в гальваническом элементе, значение Эдс гальванического элемента вычисляют как разность двух условных электродных потенциалов: E = E п – E л, (3.33) где E п– потенциал правого электрода, E л – потенциал левого. Химические цепи Гальванические элементы первого типа – химические цепи представляют собой элементы, составленные из электродов, на которых протекают различные электрохимические реакции. В основе работы всякого электрохимического элемента лежат самопроизвольные окислительно-восстановительные реакции, протекающие раздельно: на более отрицательном электроде (аноде) — окисление, на более положительном (катоде) — восстановление. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока. Например, элемент Даниэля — Якоби составлен из двух электродов первого рода цинкового и медного. Последовательность соединения их изображают схемой: Cu | Zn | ZnSO4(aq) ¦ CuSO4(aq) | Cu. (1) Cu2+(aq) + 2 e– (2) Zn2+(aq) + 2 e– Суммарная реакция, протекающая в элементе Zn + Cu2+(aq) ЭДС этого элемента
где Различают химические цепи с двумя и с одним электролитом. К электрохимическим элементам с двумя электролитами относятся рассмотренный выше элемент Даниэля — Якоби. Химические цепи с одним электролитом могут быть двух видов. В цепях первого вида один электрод обратим относительно катиона, другой — относительно аниона. Например, элемент Cd | CdCl2(aq) | AgCl | Ag Он используется для определения среднего коэффициента активности электролита CdCl2. Рассчитаем ЭДС этого элемента.
где В гальванических элементах второго вида (с одним электролитом) оба электрода обратимы относительно одного из ионов. Примером может служить элемент Hg | Hg2Cl2 | KCl (aq) | Cl2(г) | Pt Выражение для ЭДС этого элемента равно:
Если создать условия, при которых Примеры решения задач Пример 1. Укажите знаки электродов и их тип, напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения процессов, протекающих в гальваническом элементе, схема которого: Ni½NiSO4 aq║ CoSO4 aq½Co. Вычислите ЭДС этого элемента, если а Решение. 1. Так как стандартный потенциал электрода (+) Ni½NiSO4 aq║ CoSO4 aq½Co (–). Это электроды первого рода. 2. На электроде, имеющем более положительный потенциал ( На электроде, имеющем более отрицательный потенциал ( Процессы, протекающие на электродах в гальваническом элементе:
Анод Катод _______________________________ Ионно-молекулярное уравнение: Молекулярное уравнение: 3. ЭДС элемента равна: Е = Е+ – Е- =
Е = – 0,28 – (– 0,34)= 0,06 В. Так как ЭДС элемента положительная величина, то элемент работает самопроизвольно, так как Пример 2. М ожет ли самопроизвольно протекать реакция
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное и молекулярное уравнения. Определите ЭДС этого элемента при активности ионов в растворе, равных 1. Решение. 1. Составим гальванический элемент из двух электродов первого рода Cd½ CdCl2 (aq) || BiCl2 (aq) Bi. 2. В гальваническом элементе на отрицательном электроде ( (–) (+) Ионно-молекулярное уравнение: Молекулярное уравнение: 3. Так как активности ионов равны единицы, то электродные потенциалы будут равны стандартным электродным потенциалам. ЭДС элемента равна: Е = Dr G = – zFЕ. Следовательно, Dr G > 0 и рассматриваемая реакция
может протекать самопроизвольно. Пример 3. Вычислить при 298 К ЭДС следующего элемента:
Zn ½ZnCl2aq ║ СdCl2 aq ½Cd C¢ =0,005 М С²=2 М Стандартные потенциалы электродов Cd2+½Cd и Zn2+½Zn соответственно равны (– 0,402) и (– 0,763) В. Средние коэффициенты активности CdCl2 и ZnCl2 в растворах указанных концентраций равны 0,044 и 0,789. Можно ли за счет изменения концентрации ионов кадмия и цинка в растворах изменить направление тока в элементе? Решение.Имеется электрохимический элемент, составленный из двух разных электродов первого рода. Сравнивая значения стандартных электродных потенциалов этих электродов, видим, что цинковый электрод в этой цепи электрод отрицательный (Е0= – 0,763 В), а кадмиевый – положительный (Е0 = – 0,402 В). На электродах протекают реакции: (–) Zn = Zn2++2 (+) Cd2+ +2 Суммарная реакция, протекающая при работе электрохимического элемента: Zn + Cd2+ = Zn2+ + Cd. Значения потенциалов каждого электрода равны:
Значение ЭДС элемента равно:
Подставим численные значения, учитывая, что активности ионов равны средней активности э соответствующих электролитов
где Для изменения направления тока в элементе, нужно, чтобы Е(–) стало больше Е(+), т. е. чтобы Е стало отрицательным. Вычислим вначале, при каком отношении активностей ионов кадмия и цинка в растворе потенциалы электродов станут равными. В этом случае ЭДС примет значение, равное нулю.
Отсюда:
Следовательно:
Результат расчета показывает, что изменением концентраций не может быть достигнуто даже равенство потенциалов, поскольку активность ионов цинка должна быть более чем в 1012 раз больше активности ионов кадмия в растворе. Такие условия практически невозможно реализовать.
Пример 4. Разбавленный раствор FеС13 в 0,5 М НС1 (f±HCl = +0,757) взбалтывается с ртутью (при 298 К), при этом протекает реакция Fe3+ + Hg + Cl- = Fe2+ + 1/2 Hg2Cl2 Определите отношение активностей Fe3+, Fe2+/Pt относительно стандартного водородного электрода равны 0,268 и 0,771 В. Решение. Составим электрохимический элемент, в котором бы протекала требуемая по условию реакция. Выберем каломельный и окислительно‑восстановительный железный электроды. По числовым значениям стандартных электродных потенциалов делаем вывод, что отрицательным будет каломельный электрод, а положительным – железный окислительно‑восстановительный. Запишем цепь: (–) Hg, Hg2CI2 | Cl– || Fe3+, Fe2+ | Pt (+) Электродные реакции, проотекающие в этом электрохимическом элементе
(–) Hg + Cl- = 1/2 Hg2Cl2 + е- (+) Fe3+ + е- = Fe2+ и суммарную реакцию, протекающую при работе составленного нами электрохимического элемента, Hg + Fe3++ Cl- = Fe2+ + ½ Hg2Cl2. Сравнивая эту реакцию с реакцией, указанной по условию задачи и протекающей в колбе при взбалтывании FеС1з в НС1 с ртутью, делаем вывод, что реакции идентичны. Запишем выражения для электродных потенциалов и ЭДС элемента:
По условию задачи требуется найти отношение активностей ионов железа после установления равновесия. Учтем, что электрохимический элемент работает до наступления равновесия, при этом ЭДС становится равной нулю:
Выразим отсюда отношения активностей ионов железа:
Учитывая, что активность хлорид-ионов равна средней активности хлороводорода
имеем
где
Вопросы для самоконтроля 1. Дайте определение термина стандартный электродный потенциал и объясните причину возникновения разности потенциалов между каким-либо металлом и раствором одной из его солей. 2. В химическом источнике тока Pt½Fe+2, Fe+3 ║ Ag+ ½ Ag протекает реакция: Fe+2(раств)+ Ag+(раств)= Fe+3(раств)+ Ag(тв). Какое влияние (увеличение, уменьшение или отсутствие эффекта) должны оказать на напряжение источника тока следующие изменения: а) увеличение концентрации Fe+3(раств); б) одновременное увеличение концентрации Fe+3(раств) и Fe+2(раств) в одинаковое число раз; в) добавление твердого серебра; г) добавление некоторого количества NaCl в раствор, где имеются ионы серебра. 3. Как определить направление самопроизвольного химического превращения при протекании процессов в электрохимическом элементе? Дайте обоснованный ответ, в каком направлении будет протекать самопроизвольно реакция: 4.Объясните, какой смысл имеют разделяющие знаки (½и║) в схематической записи химического источника тока: Zn ½ZnSO4aq ║ CuSO4aq½Cu Укажите, где в этой схеме анод, а где катод? Объясните смысл терминов анод и катод и укажите на схеме направление потока электронов во внешней цепи. 5. Что должно произойти при введении ионов Концентрационные цепи Гальванические элементы второго типа – концентрационные цепи представляют собой элементы, составленные из электродов, на которых протекают одинаковые химические реакции, но концентрации реагирующих веществ на электродах различны. Электрическая энергия в концентрационных элементах вырабатывается за счет выравнивания концентраций веществ. Различают концентрационные цепи без переноса и с переносом. Концентрационными цепями без переноса называются элементы: а) с одинаковыми электродами, но с разными концентрациями электролитов при отсутствии непосредственного соприкосновения между растворами; б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации, опущенными в один раствор электролита; в) с газовыми электродами, одинаковыми по природе, но с разным давлением газа (с одним раствором электролита). Примером концентрационной цепи без переноса может служить амальгамная концентрационная цепь:
a2 a1, где a1 и a2 – активности кадмия в амальгаме. На электродах этого концентрационного элемента протекают следующие электрохимические реакции:
Суммарная реакция в элементе - ЭДС этого элемента вырабатывается за счет выравнивания активности кадмия в амальгамах (
Концентрационными цепями с переносом называются такие концентрационные элементы, в которых имеется непосредственная граница соприкосновения между растворами. На границе между растворами двух одинаковых электролитов разной концентрации, в результате разной подвижности катионов и анионов, возникает так называемый диффузионный потенциал Например, jD Cu | CuSO4 ¦ CuSO4 | Cu
где Запишем потенциалы обоих электродов:
Тогда ЭДС элемента будет
Как правило, различие в концентрациях веществ на разных электродах концентрационных элементов мало, поэтому диффузионный потенциал вносит существенный вклад в общую ЭДС. Существует несколько соотношений для расчета ЭДС гальванического элемента с учетом диффузионного потенциала. 1. Если электроды обратимы относительно катиона, то ЭДС гальванического элемента будет равна:
где t– –число переноса анионов, n – обще е число формульных частиц, составляющих данный электролит (общее число ионов, на которые распадается электролит), n+ — число формульных частиц катионов(число катионов, на которые диссоциирует электролит), составляющих данный электролит. Диффузионный потенциал рассчитывается в этом случае по соотношению:
Примером концентрационного гальванического элемента обратимого относительно катиона будет, например, элемент: jD Zn | ZnSO4 ¦ ZnSO4 | Zn
2. Если электроды обратимы относительно аниона, то ЭДС гальванического элемента будет равна:
где t+ – число переноса катионов, n– – число формульных частиц анионов, составляющих данный электролит. Диффузионный потенциал рассчитывается в этом случае по соотношению:
Примером концентрационного гальванического элемента обратимого относительно аниона будет, например, элемент: jD Ag | AgCl | HCl(aq) | NaCl(aq) | AgCl | Ag
3. Так как причиной возникновения диффузионного потенциала является различная подвижность ионов, то он возникает даже на границе двух различных растворов одинаковой концентрации. В этом случае для различных бинарных электролитов jD = где Диффузионный потенциал может быть величиной как положительной, так и отрицательной:
где Выбор знака “+” или “–” перед диффузионным потенциалом зависит от взаимного направления электрических полей между электродами элемента и на границе двух растворов. Если направления обоих электрических полей совпадают (см. пример), то диффузионный потенциал (абсолютная величина) прибавляется к jD (–) Ag|AgNO3(aq)–½+AgNO3 (aq)| Ag (+) (
Примеры решения задач Пример 1. Вычислите при 291 К ЭДС цепи H2,Pt|KOH(aq)|KСl(aq)|KOH(aq)|Pt,H2, φд1 φд2 с учетом диффузионных потенциалов, возникающих на границах соприкасающихся растворов. Средние коэффициенты активности для НС1, КС1, КОН примите равными единице. Ионное произведение воды равно 1,2·10 –14. Подвижности ионов водорода, хлора, калия, гидроксида при 291 К соответственно равны 315; 65,5; 64,9 и 174 См·см2. Решение. Этот элемент относится к концентрационным элементам с переносом ионов. В растворе КОН имеется некоторая концентрация (активность) Н+, обусловленная ионным произведением воды
Активность
Рассчитываем ЭДС элемента без учета φд по уравнению:
ЭДС этого элемента с учетом диффузионного потенциала можно рассчитать по уравнению:
Электрические поля на границах растворов +| – +| – КОН +| –КС1 и КС1 +| –HCl +| – +| – противоположны электрическому полю между электродами. Поэтому
Вычислим φд1,φд2 по соотношению:
Общая ЭДС цепи равна Е = 0,459 – 0,015 – 0,027 = 0,417 В. Пример 2. ЭДС элемента (–) Zn|ZnSO4(aq)||ZnSO4(aq)|Zn (+) c2=0,005 М c1 =? при 298 К составляет 0,025 В. Средние коэффициенты активности ZnSO4 в растворах разных концентраций равны 0,48 и 0,2. Рассчитайте концентрацию ZnSO4 (c 1) на положительном электроде. Решение. ЭДС этого элемента равна:
Отсюда
Откуда с1= 0,68 М.
Вопросы для самоконтроля 1. Сколько электродов может входить в состав концентрационного элемента? 2. Чем отличаются концентрационные элементы с переносом ионов от концентрационных элементов без переноса ионов? 3. Концентрационный элемент имеет вид: K(Hg)|KCl(aq)|AgCl,Ag,AgCl|KCl(aq)|K(Hg) Сколько гальванических элементов в его составе? Оцените знаки элементов, обеспечивающие самопроизвольную работу элемента. Как рассчитать ЭДС этого элемента? 4. Концентрационный элемент имеет вид: Hg, HgO|KOH(aq)|KOHaq)|HgO,Hg. К какому типу относится этот концентрационный элемент? Оцените знаки электродов, обеспечивающие самопроизвольную работу элемента. Как рассчитать ЭДС этого элемента? 5. Как связана ЭДС элемента с константами диссоциации электролитов CH3COOH и HCOOH?. К какому типу гальванических элементов относится данный элемент и почему? H2,Pt |CH3COOH(aq)|HCOOH(aq)| Pt, H2,
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 5746; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.018 с.) |

 Ag + Cl–(aq);
Ag + Cl–(aq);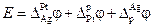 . (3.32)
. (3.32)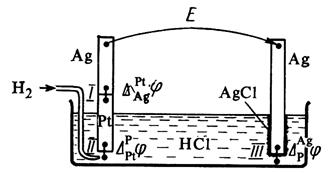
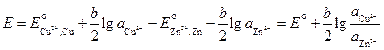 , (3.34)
, (3.34)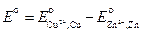 .
.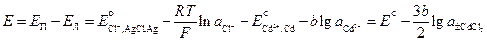 , (3.35)
, (3.35)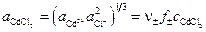 – средняя активность раствора CdCl2.
– средняя активность раствора CdCl2.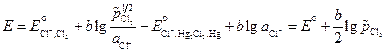 . (3.36)
. (3.36)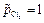 , то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.
, то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.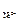 = 0,001 М, а
= 0,001 М, а 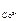 = 1 М. Стандартные потенциалы электродов соответственно равны:
= 1 М. Стандартные потенциалы электродов соответственно равны: 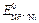 = – 0,25 В;
= – 0,25 В; 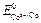 = – 0,28 В. Будет ли такой элемент работать самопроизвольно?
= – 0,28 В. Будет ли такой элемент работать самопроизвольно?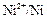 более положительный, чем у электрода
более положительный, чем у электрода 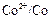 , знаки у электродов такие:
, знаки у электродов такие: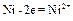 ;
;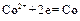 .
.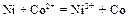 .
.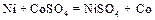 .
. –
–  .
.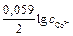 = – 0,28 + (0,059/2)lg1= – 0,28 В.
= – 0,28 + (0,059/2)lg1= – 0,28 В.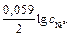 = – 0,25 + (0,059/2)lg0,001= – 0,34 В.
= – 0,25 + (0,059/2)lg0,001= – 0,34 В.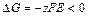 .
.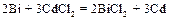
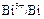 и
и 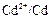 . Согласно литературным данным
. Согласно литературным данным 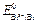 = +0,22 В, а
= +0,22 В, а 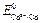 = – 0,40 В, поэтому схема гальванического элемента имеет вид:
= – 0,40 В, поэтому схема гальванического элемента имеет вид: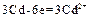 ;
;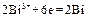 .
.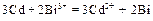 .
.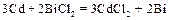 .
.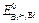 –
– 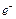 ,
,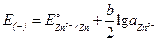 ;
;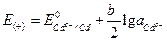 .
.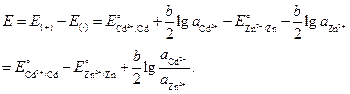
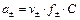 ;
; 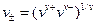 .
.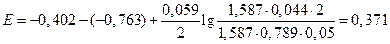 В,
В,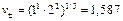 .
.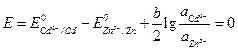 .
.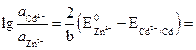
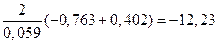 .
.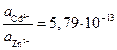 или
или 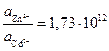 .
.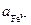 /
/ 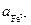 после установления равновесия в данной реакции, если стандартные потенциалы электродов Cl–/Hg2Cl2, Hg и
после установления равновесия в данной реакции, если стандартные потенциалы электродов Cl–/Hg2Cl2, Hg и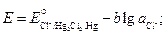
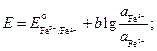
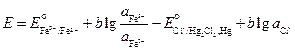 .
.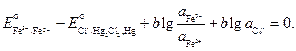
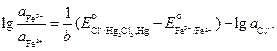
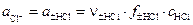 ,
,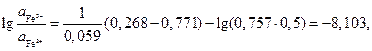
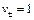 для HCl. Отсюда
для HCl. Отсюда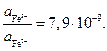
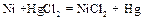
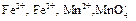 (в виде солей) в раствор, в котором содержится избыток разбавленной серной кислоты? Для объяснения воспользуйтесь значениями стандартных окислительно-восстановительных потенциалов электродов:
(в виде солей) в раствор, в котором содержится избыток разбавленной серной кислоты? Для объяснения воспользуйтесь значениями стандартных окислительно-восстановительных потенциалов электродов:  = 0,76 В;
= 0,76 В; 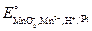 =1,52 В.
=1,52 В.
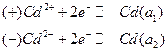 .
.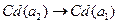 .
.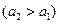 ):
):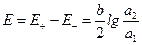 . (3.37)
. (3.37)
 >
> 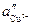
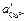 и
и 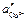 — различные активности ионов меди на электродах, jD — диффузионный потенциал, возникающий на границе растворов.
— различные активности ионов меди на электродах, jD — диффузионный потенциал, возникающий на границе растворов.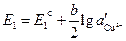 ,
,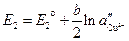 . (3.38)
. (3.38)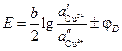 . (3.39)
. (3.39)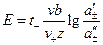 , (3.40)
, (3.40)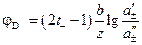 . (3.41)
. (3.41)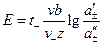 , (3.42)
, (3.42)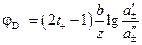 . (3.43)
. (3.43)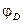 можно рассчитать по уравнению
можно рассчитать по уравнению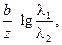
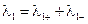 –;
–; 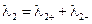 , (3.44)
, (3.44)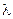 + и
+ и 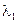 >
> 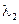 .
.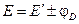 , (3.45)
, (3.45)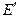 - разность потенциалов между электродами элемента, без учета
- разность потенциалов между электродами элемента, без учета 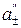 >
>  )
)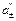
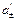
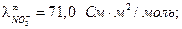
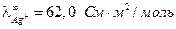 ;
; 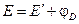 .
.
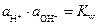 .
.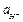 выражаем из ионного произведения воды:
выражаем из ионного произведения воды: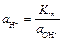 .
.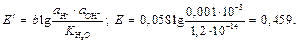
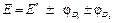 .
.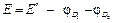 .
.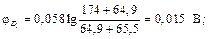
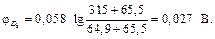
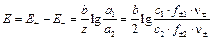 ;
;