
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация каталитических процессовСодержание книги
Поиск на нашем сайте
Классификацию каталитических процессов можно проводить по разным признакам. По фазовому составу компонентов различают гомогенные (если исходные вещества, продукты реакции и катализатор находятся в одной фазе) и гетерогенные (если реакционная смесь и катализатор находятся в разных фазах) каталитические реакции. Многие реакции, протекающие в растворах, являются гомогенными каталитическими реакциями. Гомогенно-каталитические реакции в газовой фазе «в чистом виде» встречаются редко и большинство их связано с протеканием цепных реакций. К гетерогенным каталитическим реакциям относятся процессы, протекающие на поверхности раздела фаз: газ – твёрдое тело, жидкость – твёрдое тело, жидкость – газ. В качестве катализаторов, как правило, выступают твёрдые тела: металлы, оксиды, соли и др. Ферментативный катализ – реакции, катализируемые биокатализаторами, т.е. ферментами, которые синтезируются живыми организмами и отличаются высокой специфичностью. Этот вид катализатора можно отнести к группе гомогенных каталитических реакций. Иногда их относят к микрогетерогенному катализу, когда катализатор находится в коллоидном состоянии. Недостаток такой классификации заключается в том, что в ней не учитывается основная причина каталитического действия: особенности взаимодействия катадизатора с реагирующими веществами, приводящее к изменению механизма реакции в присутствии катализатора. По механизму взаимодействия катализатор – реагент различают: гомолитический механизм катализа – каталитический процесс сопровождается разрывом некоторых электронных пар и образованием новых электронных пар и гетеролитический механизм катализа – каталитический процесс, в котором образование и разрыв двухэлектронной связи протекает без разрушения электронных пар. При таком подходе более очевидно, что природа промежуточного взаимодействия указывает на свойства, которыми должен обладать катализатор. По гомолитическому механизму осуществляются реакции синтеза аммиака, спиртов из CO и H2; гидрирования кратных связей бензола, фенола, анилина; реакции окисления SO2 в SO3, NH3 в NO, метанола в формальдегид и т.д. Катализаторами таких реакций являются вещества, способные отдавать неспаренные электроны для образования новых электронных пар. К ним относятся, прежде всего, элементы с незамещенными d - и f - оболочками в виде металлов или их соединений.
По гетеролитическому механизму протекают реакции крекинга углеводородов, дегидратации спиртов, гидратации олефинов и т.п. Конечно, и эта классификация в связи с недостатком надежных данных о глубоком механизме каталитического действия не является строгой. Однако хотя бы в общей форме она отражает особенности химической природы катализатора. Особое место в классификации занимает автокатализ – это реакции, в которых катализатор образуется в ходе их протекания. Скорость таких реакций сначала незначительна, затем увеличивается до максимального значения, после чего постепенно уменьшается, как уменьшается концентрация реагирующих веществ. Так, например, протекает реакция омыления уксусно-этилового эфира (гидролиз эфира) в нейтральной среде: CH3COOC2H5 + H2O ® CH3COOH + C2H5OH. Катализатором этой реакции являются ионы H+, которые образуются в результате самой реакции. Свойства катализаторов. 1. Каталитическая активность катализатора. Мерой каталитической активности катализатора (А) является изменение скорости химической реакции в результате введения в систему катализатора:
где v x и v 0 – скорость реакции в присутствии катализатора и без него,
Удельной каталитической активностью называют каталитическую активность, отнесенную к концентрации катализатора:
где сk – концентрация катализатора в системе. В гетерогенном катализе удельной каталитической активностью называют каталитическую активность, отнесенную к единице поверхности s твердого катализатора:
Отношение удельных активностей разных катализаторов для данной реакции можно приближенно охарактеризовать отношением констант скоростей реакций:
Для однотипных катализаторов вероятность образования активированного комплекса, следовательно, и энтропии активации с участием катализатора приблизительно одинакова:
В гомогенном ферментативном катализе мерой каталитической активности является число оборотов реакции (turnover number), т.е. количество молекул, превращающихся за единицу времени на одном активном центре:
где Число оборотов принимает различные значения в зависимости от типа катализатора: 10–7 – 10–2 с-1 для катализаторов кислотно–основного характера и 10–2 – 10–5 с-1 – для ферментов, причем у каталазы достигает значения (2,5 –5)106 с-1.
2. Селективность (избирательность) действия катализатора Селективностью (избирательностью) катализатора называют его способность ускорять один из возможных путей реакции, если она может протекать по разным направлениям с образованием различных продуктов. При оценке селективности катализатора различают дифференциальную и интегральную селективность. Под дифференциальной селективностью понимают отношение скорости образования нужного продукта к суммарной скорости превращения реагирующего вещества по всем направлениям. Например, если исходное вещество А испытывает превращения по разным последовательным и параллельным направлениям, причем по одному из этих направлений образуется требуемый продукт В, то дифференциальная селективность катализатора в отношении продукта В равна: s = где n B и n A – количество продукта и исходного вещества; b/a – отношение стехиометрических коэффициентов при образовании продукта В из исходного вещества А. Интегральной селективностью называется отношение общего количества нужного продукта при конечной степени превращения исходного вещества к теоретически возможному количеству. Селективность катализатора имеет большое практическое значение, так как, подбирая подходящий катализатор, можно увеличить выход нужного продукта.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 691; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.73.117 (0.01 с.) |

 , (5.4)
, (5.4) – доля объема системы, занимаемая катализатором и недоступная для реагирующих веществ. Часто второй член в уравнении (5.4) настолько мал по сравнению с первым, что им можно пренебречь. Поэтому каталитическая активность – величина, симбатная скорости реакции:
– доля объема системы, занимаемая катализатором и недоступная для реагирующих веществ. Часто второй член в уравнении (5.4) настолько мал по сравнению с первым, что им можно пренебречь. Поэтому каталитическая активность – величина, симбатная скорости реакции: (5.5)
(5.5) (5.6)
(5.6) . (5.7)
. (5.7) (5.8)
(5.8) . Поэтому
. Поэтому (5.9)
(5.9) (5.10)
(5.10)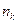 – число оборотов реакции, с-1; v – скорость реакции, моль/л·с;
– число оборотов реакции, с-1; v – скорость реакции, моль/л·с; 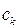 – концентрация катализатора, моль·л-1.
– концентрация катализатора, моль·л-1.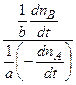 =
= 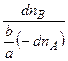 , (5.11)
, (5.11)


