
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы гомогенных каталитических реакцийСодержание книги
Поиск на нашем сайте
Промежуточное химическое взаимодействие реагентов с катализатором может протекать по двум видам механизма – слитно и раздельно. При слитном механизме с состав активированного комплекса (промежуточного соединения) входят, наряду с катализатором, все реагирующие вещества и реакция идёт по схеме: 1. A + B ® AB 2. A + B +K® ABK Увеличение скорости реакции в этом случае объясняется уменьшением энергии активации процесса При раздельном механизме каталитический процесс осуществляется поэтапно: 3. 4. Все соединения со значком ( Как правило, катализатор снижает энергию активации реакции и ускоряет её. Замедлить реакцию (не цепную) катализатор не может, так как если в присутствии катализатора энергия активации растёт, то реакция пойдёт по обычному, не каталитическому пути и скорость её окажется прежней. Замедляющее действие катализатор может оказывать на цепную реакцию, когда он ускоряет стадию обрыва цепи. Рассмотрим реакцию, протекающую по раздельному механизму [см. уравнения (3), (4)]. Согласно теории активированного комплекса, скорость реакции определяется скоростью распада комплекса на конечные продукты:
В соответствии с принципом стационарности:
Откуда:
Подставляя (5.18) в (5.16) и затем в (5.14), находим:
Это уравнение лежит в основе кинетики гетерогенно–каталитических реакций. Из (5.19) видно, что скорость образования продукта реакции прямо пропорциональна концентрации катализатора с К, что хорошо согласуется с опытом. Характерные частные случаи: 1) если k 2>> k 3, т.е. константа скорости распада промежуточного соединения АК на исходные реагенты значительно превышает константу скорости образования активированного комплекса AKB
т.е. скорость реакции прямо пропорциональна концентрации катализатора и реагентов. Промежуточное вещество (АК) называется промежуточным веществом Аррениуса. 2) если k 2 << k 3, тогда всё количество промежуточного вещества превращается в конечные продукты и скорость реакции пропорциональна концентрации вещества (A), из которого образуется вещество (АК):
Промежуточное вещество в этом случае носит название ²промежуточное вещество Вант Гоффа². Например, реакция окисления тиосульфата перекисью водорода в кислой среде с I– ионами 2S2O32- + H2O2 + 2H+ ® S4O62- + 2H2O идёт по стадиям: I– + H2O2 ® IO- + H2O, I-+ IO– + 2H+ ® I2 + H2O, I2 + 2S2O32– ® S4O62– + 2I–. В этом случае IO– – промежуточное вещество Вант Гоффа. Если же в качестве катализатора взять молибденовую кислоту, то конечным продуктом её будут сульфат ионы и вода: MoO4 + 4H2O2 ® [MoO8]2– + 4H2O, [MoO8]2– + S2O32– +H2O ® 2SO42– + 2H+ + [MoO4]2–, причём [MoO8]2– – является промежуточным веществом Аррениуса. Вопросы для самоконтроля 1. Какова роль энтропии активации в каталитической реакции? В каких случаях наблюдаются положительные или отрицательные значения энтропии активации в катализе? 2. Приведите примеры стадийного механизма каталитических реакций. В каком из двух механизмов энергии активации каталитических процессов имеют, как правило, более высокие значения? Ответ поясните 3. Приведите возможные механизмы каталитических процессов, если в отсутствие катализатора реакции протекают по схемам: а) А→Р; б) А + В →Р; в) А + В →Р1 + Р2. Примеры гомогенных каталитических реакций Все гомогенные каталитические реакции условно можно разделить на три группы: 1) кислотно-основной катализ; 2) окислительно-восстановительный катализ комплексными соединениями; 3) ферментативный катализ. Кислотно-основной катализ По определению Аррениуса (1884 г.), кислота – это соединение, образующее при диссоциации в водном растворе ионы водорода Н+; основание – это соединение, образующее при диссоциации в водном растворе гидроксид–ионы ОН–. К недостаткам определения Аррениуса следует отнести ограниченность понятия кислоты, поскольку это понятие применимо только для водных растворов и не рассматривает реакции, протекающие в органических растворителях и в газовой фазе.
Согласно общей (протонной) теории кислот и оснований Бренстеда (1923 г.), кислота – это вещество, способное отдавать протон, например, HCl, H3O, CH3COOH, NH4+, H2O и др. Под основанием понимают вещества, способные принимать протон: OH-, NH3, CH3COO-, H2O и др. Кислота и основания, связанные уравнением HA = H+ + A-, называются сопряжёнными. Протон в растворах обычно связывается с молекулами растворителя, например в воде: H+ + H2O→ H3O+. Если молекулы растворителя не способны ни присоединять, ни отдавать протоны, то растворённое вещество не может проявить кислотно-основных свойств. Такой растворитель называется апротонным. Вещество, способное и отдавать и принимать протоны, называется амфипротонным, например, вода. Существуют вещества, не содержащие водорода (SnCl4, BF3, AlCl3, ZnCl2 и др.), но кислотные свойства их хорошо известны. Поэтому Льюис (1938 г.) предложил кислотой называть любое вещество, способное использовать свободную пару электронов другой молекулы для образования устойчивой электронной конфигурации другого атома. На примере реакции SO3 + H2O Видно, что H2O является основанием, так как обладает свободной парой электронов, а SO3 – кислотой, поскольку использует эту пару электронов. Кислотами Льюиса являются такие соединения, как FeCl3, AlCl3, BF3; основаниями – NH3,N2H4, NO3–, C6H6, C6H5N. Льюисовские кислоты и основания могут и не содержать протонов, это акцепторы или доноры электронов соответственно. По Усановичу (1939 г.), кислота – это вещество, способное отдавать катионы, соединяющиеся с анионами или электронами, или нейтрализующее основание с образованием соли. Основание – это вещество, способное отдавать анионы или электроны, соединяющиеся с катионами, или нейтрализующее кислоты с образованием соли. В кислотно-основном катализе различают следующие типы реакций. 1) Специфический кислотный и основной катализ. К первым относятся реакции, в которых активация субстрата осуществляется только ионами водорода, ко вторым – только ионами гидроксила. Простейшие механизмы этих реакций включают обратимое взаимодействие субстрата (S) с каталитической частицей и превращение образующегося комплекса в продукт:
2) Общий кислотный и основной катализ – реакции с активацией субстрата любым донором протонов, кроме ионов водорода, т.е. под действием обобщённых кислот Бренстеда; и реакции с активацией любым акцептором протонов, кроме OH-, т.е. обобщённым основанием Бренстеда соответственно.
Для реакций общего кислотного или основного катализа с одним и тем же субстратом известны корреляционные соотношения Бренстеда между константами скорости каталитических реакций и константами кислотности (Ка) или основности (Кb) катализатора:
где 3) Электрофильный и нуклеофильный катализ – это реакции, в которых катализатором является соответственно кислота или основание Льюиса. 4) Общий кислотно-основной катализ – в каталитической реакции одновременно участвуют Бренстедовские кислота и основание. 5) Электрофильно-нуклеофильный катализ – в реакции участвуют одновременно кислота и основание Льюиса.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 380; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.160.239 (0.007 с.) |

 ® D + E без катализатора,
® D + E без катализатора,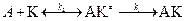 .
. .
. ) означают активированный комплекс системы, находящейся в переходном состоянии. В этих реакциях суммарная энергия активации реакции необязательно должна уменьшаться, а скорость процесса растёт за счёт роста энтропийного фактора, так как при этом растёт количество стадий и упрощается строение активированных комплексов. Реакции с раздельным и слитным механизмом протекают при разных температурах; первые – при 600 – 800 К, а вторые – в области 300 - 400 К.
) означают активированный комплекс системы, находящейся в переходном состоянии. В этих реакциях суммарная энергия активации реакции необязательно должна уменьшаться, а скорость процесса растёт за счёт роста энтропийного фактора, так как при этом растёт количество стадий и упрощается строение активированных комплексов. Реакции с раздельным и слитным механизмом протекают при разных температурах; первые – при 600 – 800 К, а вторые – в области 300 - 400 К. . (5.14)
. (5.14) . (5.15)
. (5.15) , (6.16)
, (6.16) , (5.17)
, (5.17)
 . (5.18)
. (5.18)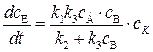 . (5.19)
. (5.19) , то
, то , (5.20)
, (5.20) . (5.21)
. (5.21) H2SO4
H2SO4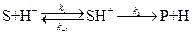 специфический кислотный катализ
специфический кислотный катализ специфический основной катализ
специфический основной катализ общий кислотный катализ
общий кислотный катализ общий основной катализ
общий основной катализ (5.22)
(5.22) – константы, не превышающие единицы.
– константы, не превышающие единицы.


