
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика односторонних химических реакций нулевого порядкаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реакции нулевого порядка – это реакции, для которых скорость реакции не зависит от концентрации реагирующего вещества. В этом случае имеем
Интегральные формы кинетического уравнения будут иметь вид
где Для реакций нулевого порядка период полупревращения зависит от начальной концентрации реагента в первой степени. Размерность константы скорости реакции нулевого порядка – Следует помнить, что константы скорости реакций различных порядков являются разными физическими величинами и сопоставление (сравнение их) значений лишено какого бы то ни было смысла. Константы скоростей одинакового порядка имеют одну и ту же размерность и поэтому их можно сравнивать.
Примеры решения задач Пример 1. Константа скорости реакции омыления этилового эфира уксусной кислоты едким натром при 283 К равна 2,38, если концентрацию выражать в кмоль/м3, а время в минутах. Вычислить время, необходимое для омыления 50% этилацетата, если смешать при 283К 1 литр 1/20 М раствора эфира с 1 л 1/20 М щелочи. Решение. Концентрации эфира и щелочи равны, поэтому для решения следует использовать уравнение (1.19):
Так как общий объем смеси равен 2л, то:
Концентрация вещества, выраженная в кмоль/м3 и в моль/л имеет одно и то же значение. Тогда: Пример 2. Раствор уксусноэтилового эфира при с 01 = 0,01М и Т =293 К омыляется 0,002 М (с 02) раствором едкого натра за время t 1=23 мин. на 10%. В какое время (t2) тот же раствор эфира прореагирует на 10% с раствором щелочи концентрацией Решение. Эта реакция второго порядка, начальные концентрации исходных веществ не равны. Следовательно, для расчета константы скорости реакции воспользуемся уравнением (1.24):
Зная значение константы скорости реакции, находим время t2:
Пример 3. Исследование a - радиоактивного изотопа полония показало, что за 14 дней его активность уменьшилась на 6,85 %. Определить период полураспада и рассчитать, в течение какого времени он разлагается на 90 %. То есть в задаче дано: С 0 = 100 %; х = 6,85 %; t = 14 дней. Решение. Эта реакция относится к реакциям первого порядка. 1) Константу скорости можно рассчитать по уравнению (1.12):
2) Период полураспада рассчитаем по уравнению (1.17):
3) Рассчитаем промежуток времени, за который изотоп разложится на 90 %:
Вопросы и задания для самоконтроля. 1. Приведите примеры химических реакций второго порядка. В каком случае их можно считать бимолекулярными? 2. Какой вид примет кинетический закон для реакции второго порядка при условии с А0 3. Укажите графический способ определения константы скорости для реакции второго порядка, когда с А0 4. Представьте графически зависимость текущей концентрации реагирующего вещества от времени для реакций различных порядков (с А0= с В0= с С0: а) 0; б) 1; в) 2; г) 3. 5. Можно ли применять понятие времени полупревращения для реакций второго порядка, когда с А0 Получите аналитические выражения для времени полупревращения по каждому веществу.
4.4.2. Методы определения порядка реакций Для выяснения механизма химической реакции и расчета константы скорости обязательно надо знать порядок реакции по веществу и суммарный порядок данной реакции. Порядок реакции является эмпирической величиной и не может быть рассчитан теоретически, если неизвестен механизм реакции. Для определения порядка реакции необходимо иметь экспериментальные данные об изменении концентрации реагирующих веществ во времени. На основании этих данных можно различными методами установить порядок реакции.
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 709; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.14.248 (0.007 с.) |

 ; v =
; v =  . (4.46)
. (4.46)
 (4.47)
(4.47)
 ,
, - изменение концентрации ко времени t.
- изменение концентрации ко времени t. .
. .
. , x = 1/80 М.
, x = 1/80 М. = 16,8 мин.
= 16,8 мин. = 0,004 м/л
= 0,004 м/л ;
;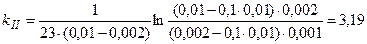 мин.-1×моль-1.
мин.-1×моль-1.
 мин.
мин.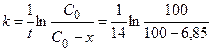 = 5,07×10-3 дней-1.
= 5,07×10-3 дней-1. дней.
дней. дня.
дня. с В0?
с В0? с В0. В каких координатах кинетическое уравнение имеет вид прямой линии?
с В0. В каких координатах кинетическое уравнение имеет вид прямой линии?


