
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярность и порядок реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Молекулярность реакции есть число частиц (атомов, молекул, ионов, радикалов), участвующих в элементарном акте. Например, реакция перегруппировки трифенил(триметилперокси)силана является мономолекулярной реакцией:
При горении водорода реакции зарождения, продолжения и разветвления цепи соответствуют бимолекулярным реакциям. В каждом элементарном акте участвуют две частицы, например Н× + О2 ® продукты реакции. Реакция обрыва цепи – тримолекулярная реакция. В каждом элементарном акте такой простой реакции участвуют три частицы (НО×, ×Н и М): НО× + ×Н + М ® Н2О + М* Роль третьей частицы М выполняет атом или молекула в стенке реактора или молекула в объеме реактора. Функция частицы М сводится к дезактивации образующейся молекулы Н2О. В результате тройного столкновения уменьшается кинетическая энергия, энергия колебательного движения атомов, способная разорвать связь в образовавшейся молекуле воды НО–Н. Часть колебательной энергии принимает на себя молекула М. Она переходит в возбужденное состояние М*, обеспечивая устойчивость молекулы воды. В соответствии с законом действия масс уравнения скорости элементарных химических реакций записываются следующим образом: для мономолекулярной реакции А ® продукты u = kcA для бимолекулярной реакции 2 А ® продукты А + В ® продукты u = kcAсВ для тримолекулярной реакции 2 А + В ® продукты B + 2 D ® продукты В общем виде для элементарной химической реакции nАА + nВВ ® продукты где ni – стехиометрические коэффициенты уравнения химической реакции, а ni – показатели степени, с которыми концентрации реагентов входят в уравнение закона действия масс. Для элементарных химических реакций стехиометрические коэффициенты и показатели степени, с которыми концентрации реагентов входят в уравнение скорости реакции, совпадают, т.е. nА = nA и nВ = nB. Показатель степени ni, с которым концентрация реагента входит в уравнение скорости реакции, обозначает порядок реакции по данному реагенту. Общий порядок реакции равен сумме показателей степеней концентраций всех реагентов, которые входят в кинетическое уравнение скорости реакции. Например, для бимолекулярной простой реакции общий порядок равен двум: nA + nB. = 1 + 1 = 2. Для мономолекулярной реакции превращения А в продукт реакции В: А ® В должно выполняться условие соударений как источник активационной энергии. Общепринятой схемой активирования молекул А в результате бимолекулярных соударений является схема Линдемана (1922 г.): А + А ® А* + А (k 1) бимолекулярная активация А* + А ® А + А (k 2) бимолекулярная дезактивация А* ® В (k 3) распад с образованием продукта Бимолекулярные процессы активации и дезактивации обеспечивают некоторую стационарную концентрацию активированных молекул А*. Энергия столкновения превращается в колебательную энергию активированной молекулы А*. Через некоторое время молекула А* либо дезактивируется, либо распадется с образованием продукта реакции В. Скорость расходования и образования активированных молекул в соответствии с принципом стационарности выражается уравнением:
или Скорость превращения А в В определяется скоростью реакции А* ® В:
Подставляя в это уравнение концентрацию сА* из уравнения (5.9), получим выражение для скорости мономолекулярной реакции:
При большой концентрации вещества А, когда скорость дезактивации во много раз больше скорости распада, т.е. * k 2 cAcA* >> k 3c A* или k 2 cAcA* >> k 3c A, первым слагаемым в знаменателе уравнения (5.10) можно пренебречь по сравнению со вторым. В результате получим:
или u = kcA, где Мономолекулярное превращение вещества подчиняется уравнению реакции первого порядка. Тримолекулярные элементарные реакции встречаются чрезвычайно редко. Вероятность тройного столкновения мала по сравнению со столкновениями двух частиц. Не имеет смысла говорить о молекулярности сложной реакции. Она включает главным образом элементарные моно- и бимолекулярные реакции. Для сложных реакций частный и общий порядок реакции выражается как целыми, так и дробными числами, которые находят экспериментально. Например, скорость сложной реакции H2(г)+ Br2(г) = 2HBr(г) описывается уравнением:
включающим целочисленные и дробные частные порядки. Сложная реакция H2(г)+ I2(г) = 2HI(г) является реакцией второго порядка
Формально наблюдается совпадение стехиометрических коэффициентов и частных порядков в уравнении скорости реакции. Но это лишь совпадение. Исследование механизма этой реакции показало, что образование HI включает моно- и тримолекулярные элементарные реакции.
Реакции первого порядка Рассмотрим применение основного закона кинетики к простым односторонним (необратимым) реакциям. Для реакции первого порядка А ® продукты реакции
Разделим переменные и интегрируем уравнение в пределах от начальной концентрации сА = с 0 (при t = 0) до сА = с, соответствующей моменту времени t.
Введем понятие период полураспада t1/2 – время, за которое превращается половина исходного реагента. К моменту времени t1/2 концентрация исходного вещества А уменьшается наполовину сА = с 0/2. Подставим в уравнение (5.12) время, соответствующее периоду полураспада вещества А:
Как видно, период полураспада мономолекулярной реакции не зависит от концентрации реагирующего вещества и определяется значением константы скорости реакции. За промежуток времени, равный периоду полураспада, превращается половина текущей концентрации реагента (рис. 55). Если t 1/2 вещества А равен 5 мин, то при любой концентрации вещества А за отрезок времени, равный 5 мин, эта концентрация уменьшится вдвое. Воспользовавшись уравнением (5.12), представим зависимость текущей концентрации реагента А от времени
Рис. 55. График изменения концентрации вещества А от времени реакции
Пример. Классическим процессом, подчиняющимся уравнению реакции первого порядка, является радиоактивный распад. Например, известно, что радиоактивный йод
Период полураспада йода-131 равен 8.06 дня. Вычислим время, которое потребуется, чтобы относительное содержание иода-131, оказавшееся в щитовидной железе человека, уменьшилось в 1000 раз. Решение. Вычислим константу скорости радиоактивного распада по уравнению (5.13):
Подставим значение константы скорости превращения радиоактивного иода-131 в уравнение (5.12)
В течение 80 дней человек, в щитовидную железу которого попал радиоактивный йод-131, подвергается опасному облучению, прежде чем концентрация его уменьшится в 1000 раз.
Краткий итог темы 1. Все химические процессы протекают в пространстве и во времени. Под пространством подразумевается объем, занимаемый реагентами. Время реакции зависит от скорости превращения исходных веществ в продукты реакции. 2. Следует различать сложные реакции (совокупность последовательно и параллельно протекающих простых реакций) и простые реакции, идущие в один акт, в одно действие. 3. Знание механизма реакции позволяет определить, какая элементарная реакция является наиболее медленной, подобрать условия, изменяющие её скорость, и, следовательно, скорость реакции в целом. 4. Теория соударений выделяет три условия, выполнение которых обеспечивает химическое превращение реагентов: 1) столкновение реагентов; 2) столкновение с энергией активации Е; 3) столкновение реакционными центрами. 5. Теория активированного состояния сосредоточивает внимание на том, что разрыв и образование химических связей при взаимодействии реагентов происходит в результате непрерывного изменения межатомных расстояний. 6. С увеличением концентрации реагентов скорость реакции увеличивается в соответствии с законом действия масс. 7. С увеличением температуры на 10 градусов скорость реакции увеличивается в 2 – 4 раза (правило Вант-Гоффа). Если известна энергия активации реакции Е, изменение скорости реакции с температурой можно рассчитать по уравнению Аррениуса. 8. Введение катализатора увеличивает скорость реакции. Роль катализатора сводится к понижению активационного барьера реакции. Катализатор участвует в химических реакциях. После завершения процесса катализатор сохраняется в неизменном виде. 9. Имеет смысл говорить о порядке и молекулярности простых реакций, включающих однотипные элементарные химические превращения. Сложная реакция включает главным образом моно-, бимолекулярные реакции, реже тримолекулярные реакции.
Термины для запоминания Речь взаимосвязана с мышлением. Она отражает нашу способность мыслить и качество мышления (как говорим, так и думаем). Поэтому старайтесь воспроизводить главное из прочитанного лучше всего письменно (черновики). Ваша речь при объяснении материала должна сочетать ясность изложения с грамматически правильным построением фраз. u = k × cA × cBC 1) столкновение реагентов; 2) столкновение с энергией активации Е; 3) столкновение реакционными центрами. А + ВС ® АВ + С Звено цепи есть последовательность элементарных химических актов продолжения цепи, заканчивающаяся на исходном атоме или радикале. Инициирование или зарождение цепи – реакция образования активных частиц, атомов и радикалов из молекул. Катализатор – вещество, участвующее в химических превращениях и увеличивающее скорость реакции, но после завершения процесса остающееся в неизменном состоянии и количестве. Каталитической называется реакция, скорость которой возрастает при введении катализатора. Механизм химической реакции есть совокупность последовательно и параллельно протекающих элементарных химических актов, обеспечивающих превращение исходных веществ в конечные продукты. Молекулярность реакции определяется числом частиц (атомов, молекул, ионов, радикалов), участвующих в элементарном акте. Н× + О2 ® НО× + ×О× Н× + О2 ® НО× + ×О× Н2 + ×О×® НО× + Н× Н2 + О2 ® Н× + НОО× Необратимая реакция – это реакция количественного превращения исходных веществ в продукты. НО× + ×Н + М ® Н2О + М* НО× + Н2® Н2О + Н.× Обрыв цепи – гибель атома или радикала в результате реакции между ними. Общий порядок реакции равен сумме показателей степеней концентраций всех реагентов, которые входят в кинетическое уравнение скорости реакции. Например, для простой бимолекулярной реакции общий порядок равен двум: nA + nB. = 1 + 1 = 2. Основной закон химической кинетики (закон действия масс) утверждает, что скорость простой реакции в каждый момент времени прямо пропорциональна произведению концентраций реагирующих веществ. Период полураспада t1/2 – время, за которое превращается половина исходного реагента. Порядок реакции по данному реагенту – это показатель степени ni, с которым концентрация реагента входит в уравнение скорости реакции. Правило Вант-Гоффа утверждает: при увеличении температуры на 10 0С скорость реакции увеличивается в 2 – 4 раза. Продолжение цепи – реакция атомов и радикалов с молекулами исходных веществ с образованием продуктов реакции и сохранением атомов и радикалов. Простая реакция состоит из одних и тех же элементарных химических актов. Разветвление цепи – образование нескольких активных частиц (атомов и радикалов) из одной активной частицы (атома или радикала). Сванте Аррениус эмпирически установил зависимость константы скорости химической реакции k от температуры k = k0× Скорость гомогенной химической реакции определяется изменением концентрации реагента или продукта реакции во времени. Сложная реакция складывается из нескольких разнотипных простых реакций. Теория соударений выделяет три условия, выполнение которых обеспечивает химическое превращение реагентов. Химическая кинетика – раздел физической химии, изучающий скорость и механизм химических процессов. Цепная реакция – процесс, в котором превращение исходных веществ в продукты осуществляется путем многократного чередования элементарных актов с участием свободных радикалов и атомов. Элементарный химический акт – столкновение микрочастиц, результатом которого является химическое превращение, совершающееся в один акт, в одно действие.
Вопросы для проверки знаний 1. В чем различие между простой и сложной реакцией? 2. Чем похожи простая и элементарная реакции? 3. Согласны ли вы с утверждением, что порядок и молекулярность сложной реакции совпадают? 4. Согласны ли вы с утверждением, что скорость реакции соответствует изменению массы реагента в единицу времени? 5. Объясните, почему скорость реакции прямо пропорциональна произведению концентраций, а не сумме концентраций реагирующих веществ? 6. Дайте определение каталитической реакции. 7. Какой из факторов с позиции теории активированного комплекса изменяет катализатор? 8. Изменяет ли катализатор константу химического равновесия?
Упражнения 1. Реакция между водородом и йодом H2 + I2 ⇄ 2HI является сложной и осуществляется при участии двух элементарных реакций I2 ⇄ 2I (быстро); Н2 + 2I → 2HI (медленно); Докажите, что скорость сложной реакции между водородом и йодом подчиняется уравнению реакции второго порядка 2. Во сколько раз возрастет скорость простой реакции А + 2 В → продукты реакции, если концентрацию реагента А увеличили в 2 раза, а концентрацию реагента В в 4 раза? 3. Для простой необратимой реакции первого порядка А → В концентрация реагента А изменяется со временем следующим образом:
Вставьте в таблицу численные значения концентрации продукта В за этот отрезок времени. 4. Для простой необратимой реакции первого порядка А → 2В концентрация реагента А изменяется со временем следующим образом:
Вставьте в таблицу численные значения концентрации продукта В за этот отрезок времени.
П р и л о ж е н и е Энтальпии образования и абсолютные значения энтропии
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 742; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |

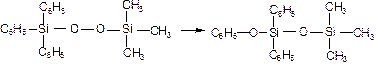



 ,
, (5.8)
(5.8)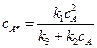 . (5.9)
. (5.9) .
. . (5.10)
. (5.10)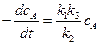 (5.11)
(5.11) .
. ,
,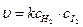 .
. .
. ,
, ,
, . (5.12)
. (5.12) ,
, . (5.13)
. (5.13) . (5.14)
. (5.14)
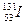 распадается с выделением из ядра атома электрона (b -распад) и образованием инертного газа – ксенона-131:
распадается с выделением из ядра атома электрона (b -распад) и образованием инертного газа – ксенона-131:
 ,
, .
. ,
,
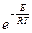 , где k0 – предэкспоненциальный множитель, Е – энергия активации реакции.
, где k0 – предэкспоненциальный множитель, Е – энергия активации реакции. (константа равновесия)
(константа равновесия) .
. .
.


