Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние концентрации участников реакции на смещение химического равновесияСодержание книги
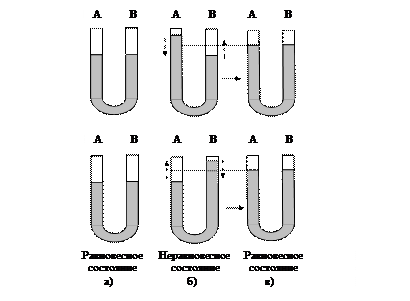
Поиск на нашем сайте Модель смещения химического равновесия А ⇄ В напоминает механическую модель смещения равновесия жидкостей в сообщающихся сосудах (рис. 48).
Рис. 48. Механическая модель равновесия: а - равновесное состояние; б - нарушение равновесного состояния, в левое (или правое) колено добавлена жидкость; система стремится ослабить внешнее воздействие, оно указано стрелками; в- новое равновесное состояние: система уменьшила внешнее воздействие
Процесс изменения концентраций, вызванный нарушением равновесия, называется сдвигом или смещением равновесия. Равновесие смещается вправо, так как добавленные в избытке исходные вещества реагируют между собой и дают дополнительное количество продукта реакции. В этом случае концентрации исходных веществ в левой части уравнения возросли подобно тому, как увеличился столб жидкости в левом (или правом) колене сообщающихся сосудов (рис. 48). В общем случае при увеличении концентрации (парциального давления) какого-либо из веществ в равновесной системе равновесие смещается в сторону расходования этого вещества. Смещение равновесия происходит в соответствии с принципом подвижного равновесия: если на систему, находящуюся в равновесии, оказать воздействие (изменить концентрацию, температуру, давление), то произойдет смещение равновесия в том направлении, которое ослабит внешнее воздействие. Принцип сформулирован в 1884 г Ле-Шателье и назван его именем.
Краткий итог темы 1. Термодинамика исследует общие свойства систем, находящихся в состоянии термодинамического равновесия, и переход из одного состояния в другое сопровождается преобразованием теплоты в работу и другие виды энергии. 2. Важнейшими понятиями в термодинамике являются внутренняя энергия, теплота и работа. Внутренняя энергия включает кинетическую и потенциальную энергию микрочастиц системы. 3. В соответствии с первым законом термодинамики полное количество энергии должно сохраняться в любом процессе. Перераспределение энергии системы осуществляется необратимым образом в соответствии со вторым законом термодинамики. 4. Температура тела определяется средней кинетической энергией микрочастиц. Чем выше скорость движения микрочастиц, тем выше температура тела. 5. Термическое равновесие между телами устанавливается при достижении одной и той же средней кинетической энергии микрочастиц контактирующих тел. 6. Работа является макрофизической формой обмена энергией системы и окружающей среды. Теплота – микрофизическая форма передачи энергии. Человек научился превращать потенциальную энергию (скрытую в химических связях и межмолекулярных взаимодействиях) в кинетическую энергию движения микрочастиц. При горении топлива в теплогенерирующих установках получают энергию в форме теплоты и работы. 7. Термодинамические расчеты позволяют теоретически по знаку изменения функции Гиббса D rG 0(Т) предсказать направление самопроизвольного процесса. 8. Константа равновесия химической реакции является функцией температуры, следовательно только температура изменяет её численное значение. Изменение концентрации или давления в системе при постоянной температуре не изменяет константу равновесия, а смещает равновесие так, что изменившееся соотношение концентраций остается неизменным.
Термины для запоминания Следует помнить определения и термины. Необязательно воспроизводить их дословно. Можно выразить своими словами, но без искажения смысла. Если возникают затруднения при усвоении материала, следует прочитать еще раз тот раздел, в котором он обсуждается. Воспроизведение понятий и определений лучше выполнять в письменной форме. Абсолютная температура системы Т определяется средней кинетической энергией (энергией движения) микрочастиц. Внутренняя энергия U есть сумма кинетической и потенциальной энергии всех видов микрочастиц, составляющих систему:U = S Е кин. + S Е пот. Второй закон термодинамики: 1) невозможен круговой (циклический) процесс, имеющий своим единственным результатом превращение теплоты в работу; 2) в изолированной системе самопроизвольно идут процессы в сторону рассеяния энергии и увеличения беспорядка. Закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно; она лишь превращается из одних видов в другие в строго эквивалентных количествах. Закон термического равновесия: две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом. Окружающая среда есть то, что находится вне границ системы и взаимодействует с нею. Основной закон термохимии (закон Гесса): энтальпия реакций, протекающих либо при V,T = const, либо p,T = const, не зависти от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы. Первый закон термодинамики: энергия, полученная (отданная) системой в форме теплоты, равна алгебраической сумме изменений её внутренней энергии и совершенной ею (над ней) работы. Под кинетической составляющей внутренней энергии подразумевается энергия поступательного, вращательного, колебательного, деформационного и других видов движения микрочастиц системы. Принцип подвижного равновесия: если на систему, находящуюся в равновесии, оказать воздействие (изменить концентрацию, температуру, давление), то произойдет смещение равновесия в направлении ослабления внешнего воздействия. Работа А – это форма обмена энергией системы с окружающей средой посредством направленного движения микрочастиц, составляющих макросистему. Теплоемкость – количество энергии в форме теплоты, затраченное на нагревание одного моля или одного грамма вещества на 1 К. Теплота Q есть форма передачи энергии от одного тела другому посредством соударения микрочастиц, составляющих тела. Термодинамика – область физики, изучающая общие свойства систем, находящихся в состоянии термодинамического равновесия, а также процессы обмена систем энергией в форме теплоты и работы. Термодинамическая система – это конкретный объект исследования, выделенный из окружающего мира реально существующими или воображаемыми поверхностями раздела. Например, сосуд, в котором происходит химическая реакция, газ в замкнутом сосуде или кусок плавящегося льда в стакане. Термодинамическое равновесие –такое состояние системы, свойства которой не обнаруживают заметных изменений в течение времени. Термохимическое уравнение – уравнение химической реакции, указывающее агрегатные состояния участников процесса и энтальпию процесса. Третий закон термодинамики: энтропия правильно сформированного твердого тела при абсолютном нуле равна нулю. Энергия – есть качественная и количественная характеристика движения и взаимодействия материи. Энтальпия образования DfH0 сложного вещества есть энтальпия реакция синтеза его из простых веществ, взятых в наиболее устойчивых физических состояниях, при заданных внешнем давлении (p = 1атм) и температуре Т. Энтальпия реакции D rН0 равна количеству энергии в форме теплоты, выделяющаяся или поглощающаяся в результате реакции при постоянных давлении (р = 1 атм) и температуре Т. Энтропия – есть мера рассеяния энергии и беспорядка системы. Вопросы для проверки знаний 1. В чем различие между химической и термохимической реакциями? 2. Приведите примеры экзотермической и эндотермической реакций. 3. В чем различие между энтальпией реакции и энтальпией образования вещества? 4. Что подразумевается под внутренней энергией системы? 5. Объясните, почему и теплота и работа относятся к процессу, а внутренняя энергия к состоянию системы? 6. Что, на ваш взгляд, является причиной самопроизвольного химического процесса и почему? 7. Согласны ли вы с утверждением, что если горячее и холодное тела вступают в контакт, то одинаковыми становятся не только температуры тел, но и внутренние энергии тел? 8. Что подразумевается под температурой тела? 9. Каким образом можно использовать энергии связей для расчета энтальпии химической реакции? 10. Согласны ли вы с утверждением, что передача энергии в форме тепла от горячего тела к холодному не противоречит первому закону термодинамики? 11. Как вы думаете, противоречит ли работа домашнего холодильника, в котором морозильная камера отдает энергию (еще больше охлаждаясь) задней горячей стенке, расположенной снаружи, второму закону термодинамики? 12. Согласуется ли со вторым законом термодинамики тот факт, что при росте из желудя дуба происходит наращивание количества вещества и, соответственно, концентрирование энергии в химических соединениях дерева? Упражнения 1. В табл.4 приведены термодинамические данные для графита и алмаза. Докажите, что реакция С(алмаз) ® С(графит) термодинамически разрешена. 2. Воспользуйтесь термодинамическими данными и установите, возможна ли самопроизвольная реакция СаО(кр.) + Н2О(ж) ® Са(ОН)2(кр.). 3. Воспользуйтесь термодинамическими данными и установите, возможна ли самопроизвольная реакция Са(ОН)2(кр.) + СО2(г) ® СаСО3(кр.) + Н2О(ж). 4. Воспользуйтесь термодинамическими данными и докажите, что плавление льда и испарение жидкой воды сопровождаются возрастанием энтропии вещества.
ТЕМА 5
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 335; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.008 с.) |