Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон термического равновесияСодержание книги
Поиск на нашем сайте
Для одноатомных газов кинетическая энергия есть энергия поступательного движения. Из классической механики известно, что энергия поступательного движения частицы определяется её скоростью и массой.
где m – усредненная масса и u – средняя скорость движения атомов. Из статистической физики следует, что средняя кинетическая энергия частицы, обладающей только поступательным движением, прямо пропорциональна свойству системы – температуре Т.
где k – постоянная Больцмана; T – абсолютная температура. Совместное решение уравнений (4.1) и (4.2) приводит к выражению абсолютной температуры как величины, прямо пропорциональной средней кинетической энергии микрочастиц системы
Для таких объектов, как атомы, например атомы инертных (благородных) газов, температура определяется энергией поступательного движения. В случае многоатомных молекул кинетическая энергия включает энергию различных видов движения. Представим модель трехатомной молекулы в виде шариков, связанных пружинками. Для такой молекулы характерна энергия поступательного, колебательного движения атомов в молекуле, а также вращательного и деформационного движения (рис. 33). Е кин. = Е пост. + Е колеб. + Е вращ. + Е деформ.
Рис. 33. Формы движения трехатомной молекулы
Для системы, состоящей из громадного числа микрочастиц разной массы и совершающих разнообразные движения, а не только поступательное движение, температура системы является отражением всех форм движения частиц и абсолютная температура системы Т определяется средней кинетической энергией микрочастиц. Рассмотрим построение термометрической шкалы на примере расширения – сжатия газа. Для идеального газа характерны два свойства: 1) объем молекул газа, много меньше объема, занятого всем газом; 2) радиус взаимодействия двух молекул значительно меньше среднего расстояния между ними. Идеальных газов как таковых не существует, но можно взять инертный газ или молекулярный азот. Они с успехом выполняют функцию идеального газа. Заполним газом сосуд постоянного объема (V = const). Измерим давление газа (р 2) в сосуде при температуре кипящей воды (Т 2) и давление газа (р 1) при температуре таящего льда (Т 1). При постоянном атмосферном давлении (р = 1 атм) эксперимент всегда дает одно и то же отношение давлений газа в кипящей воде и плавящемся льду:
Сделаем первое допущение, примем, что отношение давлений прямо пропорционально отношению температур
тогда Введем второе допущение, примем, что разность температур Т 1 и Т 2 равна 100 Т 2 – Т 1 = 100. (4.5) Совместное решение уравнений (4.4) и (4.5) позволяет установить численное значение температуры кипения воды и плавления льда по так называемой абсолютной шкале температур. Температура кипения воды Т 2 = 373.15 К, а температура плавления льда Т 1 = 273.15 К. Абсолютная шкала температур всегда положительна. Она введена английским физиком У. Томсоном (лордом Кельвином). Закон термического равновесия утверждает, что две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом (рис. 34).
Рис. 34. Термическое равновесие между телами. Если Т 1 = Т 3 и Т 2 = Т 3, то Т 1 = Т 2
Первый закон термодинамики Любая система обладает энергией. Энергия – есть качественная и количественная характеристика движения и взаимодействия объектов материального мира. Твердые тела, жидкости и газы проявляют разнообразные свойства, зависящие от природы атомов и молекул, составляющих эти тела. Они способны обмениваться энергией с окружающей средой, изменять агрегатное состояние в результате фазовых переходов или химический состав в результате реакций, проявлять (или не проявлять) ионную и электронную проводимость, разную степень теплопроводности, теплоемкости и бесчисленное число других физико-химических свойств. Процесс изменения физико-химического состояния вещества подчиняется фундаментальному закону сохранения энергии: энергия не возникает из ничего и не исчезает бесследно; она лишь превращается из одних видов в другие в строго эквивалентных количествах. Закон есть результат многовековых наблюдений, подтверждается экспериментальными данными и не имеет исключений. Первый закон термодинамики есть частный случай закона сохранения энергии. Он применим к тепловым процессам, в которых обмен системы энергией с окружающей средой осуществляется в форме теплоты Q и работы А. Рассмотрим систему, представляющую собой идеальный газ в цилиндре под поршнем (рис. 35). Внешним источником энергии для такой системы выступает нагреватель. Пусть нагреватель передает идеальному газу некоторое количество энергии в форме теплоты Q [Дж]. В результате такого воздействия увеличивается внутренняя энергия системы D U (поднимается температура газа) и совершается работа А перемещения груза на некоторую высоту. В соответствии с законом сохранения энергии получаем: Q = D U + А (4.6) Уравнение (4.6) является аналитическим выражением первого закона термодинамики: энергия, полученная (отданная) системой в форме теплоты, равна алгебраической сумме изменения её внутренней энергии и совершенной ею (над ней) работы.
Рис. 35. Изменение энергетического состояния системы (газ в цилиндре под поршнем) при нагревании
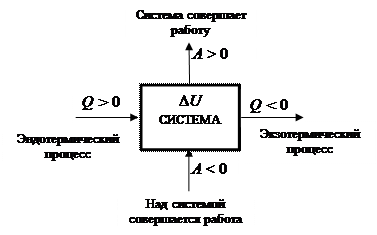
Формулировка первого закона указывает, что движение энергии возможно в любых направлениях и к системе, и от неё. На рис. 36 демонстрируются принятые в термодинамике знаки для работы, теплоты и внутренней энергии.
Пример. При сгорании 10 л бензина в автомобильном двигателе выделилось энергии в форме теплоты Q (горение) = 460×103 кДж. На нагревание окружающей среды (раскаленные выхлопные газы) затрачено энергии в форме теплоты Q (окр. среда) = 345×103 кДж. Часть энергии сгоревшего бензина израсходована на увеличение внутренней энергии D U = 10×103 кДж (нагревание двигателя). Вычислить количество бензина, израсходованное на движение автомобиля. И определить коэффициент полезного действия машины, работающей на бензине.
Решение Согласно первому закону термодинамики Q = D U + А 460×103 + (-345×103)= 10×103 + А А = 105×103 кДж. Коэффициент полезного действия h равен: h Из 10 л бензина на движение автомобиля расходуется V = 10×0,228 = 2.28 л, а 7.72 л израсходованы на нагревание окружающей среды, включая нагревание двигателя, который при остывании также нагревает воздух.
В термодинамике принята следующая система знаков для оценки направления процессов обмена энергией системы с окружающей средой (рис. 36).
Рис. 36. Модель возможных маршрутов обмена энергией системы с окружающей средой в форме теплоты и работы
Эндотермический [ др.-греч endon внутри, qermh тепло] процесс – есть процесс, происходящий с поглощением системой энергии в форме теплоты (Q) из окружающей среды. Численное значение (Q) берется со знаком плюс, например, (Q) = + 100 кДж. Экзотермический [др.-греч. exw снаружи, вне] процесс – есть процесс, происходящий с выделением системой энергии в форме теплоты (Q) в окружающую среду. Численное значение берется со знаком минус, например, (Q) = - 100 кДж. Для работы знаки выбираются иначе. Если система совершает работу, она считается положительной. Например, автомобиль (система) везет пассажиров. Но если приходится пассажирам толкать машину, у которой заглох двигатель, то эта работа считается отрицательной.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 269; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.178.145 (0.007 с.) |

 , (4.1)
, (4.1) , (4.2)
, (4.2) . (4.3)
. (4.3)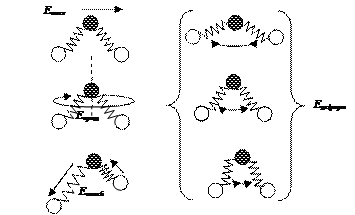
 .
. ,
, . (4.4)
. (4.4)

 .
.