
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приближенное вычисление функции Гиббса.Содержание книги
Поиск на нашем сайте
Третий закон термодинамики В зависимости от требуемой точности вычисление изменения функции Гиббса (в дальнейшем будем это изменение называть просто функцией Гиббса) по уравнению 4.35 может быть сделано в трех классических приближениях. Мы ограничимся приближенным расчетом. Будем считать, что
Для вычисления Обратим внимание на абсолютные значения энтропии химических соединений Согласно уравнению второго закона термодинамики
Интегрируем уравнение (4.37) в пределах от 0 до Т
Т а б л и ц а 4 Стандартные энтальпии образования и абсолютные энтропии Некоторых веществ
Согласно статистической термодинамике, энтропия является мерой беспорядка. М. Планк предложил постулат: энтропия правильно сформированного твердого тела при абсолютном нуле равна нулю. Это формулировка третьего закона термодинамики. При температуре Т =0 К все вещества находятся в твердом состоянии, а кристалл с идеальной упорядоченностью должен иметь В соответствии с третьим законом термодинамики абсолютная энтропия индивидуального вещества при температуре Т К определяется по формуле:
На пути перехода кристаллического вещества от 0 до Т встречаются фазовые переходы кристалл – жидкость и жидкость – газ. Энтропия фазовых переходов учитывается при вычислении абсолютного значения энтропий. Пример. Для получения негашеной извести используют минерал СаСО3. Определим температуру разложения карбоната кальция. Считаем, что процесс идет про постоянном давлении р = 1 атм (давление углекислого газа). СаСО3(т) ® СаО(т) + СО2(г); Для расчета температуры разложения СаСО3 воспользуемся функцией Гиббса D rG 0 = D rН 0 – Т D rS 0 и рассчитаем
делая допущение, что D rН 0 и D rS 0 не зависят от температуры. Величины
Находим температуру разложения СаСО3, при которой достигается термодинамическое равновесие, т. е.
Выше 833 0С реакция разложения карбоната кальция с образованием углекислого газа и оксида кальция (негашеной извести) термодинамически разрешена.
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 197; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.186.26 (0.007 с.) |

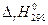 и
и  не зависят от температуры, т.е. сохраняют свои значения, определенные при 298 К, и при других значениях температуры Т, тогда
не зависят от температуры, т.е. сохраняют свои значения, определенные при 298 К, и при других значениях температуры Т, тогда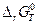 =
=  , приведенные в табл. 4.
, приведенные в табл. 4. или
или  . (4.37)
. (4.37)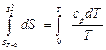 ,
, . (4.38)
. (4.38) , кДж/моль
, кДж/моль
 .
. . (4.39)
. (4.39) или» 833 0С.
или» 833 0С.


