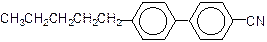Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Твердые вещества, жидкости и газыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химия изучает превращения веществ, находящихся в различных агрегатных состояниях. В отличие от такой микросистемы, как индивидуальный атом, молекула или ион, макросистема представляет собой твердое, жидкое или газообразное тело, состоящее из взаимосвязанных атомов, молекул или ионов. Например, 18 г воды содержат 6.02×1023 молекул Н2О. Свойства макросистемы не сводятся к сумме свойств атомов, молекул или ионов, входящих в её состав. Нельзя сказать, что изолированная молекула Н2О есть частица твердая, жидкая или газообразная. У нее нет этих свойств. Она не обладает теплопроводностью, теплоемкостью – свойствами, присущими множеству молекул кристалла льда, капле жидкости или пузырьку пара. Но кристалл льда, капля жидкости или пузырек пара «наследуют» химические свойства, проявляемые молекулой воды. Все химические превращения – это превращения атомов, молекул или ионов, из которых тела состоят. Атомы, молекулы, ионы обладают способностью взаимодействовать между собой. Благодаря этому свойству они образуют конденсированные продукты, жидкие или твердые. Нет ни одного газа, который при понижении температуры и увеличении давления не переходил бы в конденсированное состояние. Для полноты представлений о строении вещества рассмотрим особенности строения конденсированных сред.
Модели кристаллических и аморфных веществ В кристаллическом веществе атомы, ионы или молекулы располагаются в строгом порядке в узлах кристаллической решетки. По типу химической связи и межмолекулярного взаимодействия кристаллические решетки делятся на ковалентные (атомные), ионные, металлические и молекулярные. Мы уже приводили модели ионных и металлических кристаллических веществ. Далее представлены все возможные модели кристаллических веществ, классифицированные по типу химической связи и межмолекулярному взаимодействию.
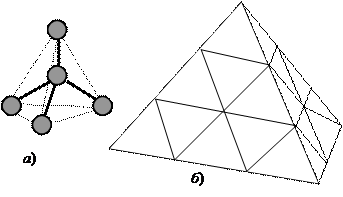
Кристаллы Кристаллы с ковалентными связями представляют собой структуры химически связанных атомов. Примером кристалла с ковалентными связями может служить алмаз (рис. 21). Кристаллическая решетка алмаза гранецентрированная кубическая. Кристаллы обычно имеют форму октаэдра, ромбододекаэдра, куба или тетраэдра.
Рис. 21. Модель структуры кристалла алмаза: а) фрагмент кристаллической решетки: центральный атом углерода окружен четырьмя равноудаленными атомами углерода, находящимися в углах тетраэдра; б) кристалл, построенный из тетраэдрических фрагментов
Кристаллы с ионными связями – это твердые тела, состоящие из химически связанных положительно и отрицательно заряженных ионов. Их кристаллическая решетка построена так, что силы электростатического притяжения и отталкивания разноименно и одноименно заряженных ионов уравновешены. Ионную кристаллическую решетку имеют соли, оксиды металлов, основания, комплексные соединения. Структура кристаллической решетки зависит от размеров и природы катионов и анионов. Например, на рис. 22 представлена кубическая кристаллическая решетка хлорида натрия.
Рис. 22. Модель ионной кристаллической решетки хлорида натрия. Пунктирные линии приведены для того, чтобы показать объемность кристалла
Молекулярные кристаллы содержат в узлах кристаллической решетки молекулы, которые удерживаются между собой силами электростатического притяжения. Например, такую кристаллическую решетку образуют диполи молекулы воды (рис. 23). Диполь – совокупность двух равных по величине разноименных зарядов (d), находящихся на некотором расстоянии (l) друг от друга. Заметим, что d указывает на долю от целого заряда, которая приходится на участок электронейтральной молекулы. Диполи воды располагаются в кристалле льда (рис. 24) в виде прочной тетраэдрической кристаллической решетки. Центры тяжести положительных и отрицательных зарядов в молекулах не совпадают.
 рис. 25. рис. 25.

 
Рис. 23. Модели молекулы воды: а) атом кислорода в молекуле воды находится в sp3 гибридном состоянии; б) диполь
Рис. 24. Фрагмент кристалла льда
Дипольный момент m такой молекулы вычисляется по уравнению m = δ× l, где δ – величина заряда; l – расстояние между центрами тяжести положительного и отрицательного зарядов молекулы (рис.23 б). Один из способов объяснения природы металлической связи основывается на представлении об электронном газе.
Кристаллы с металлическими связями представляют собой упорядоченные структуры положительно заряженных ионов, удерживающихся в кристаллической решетке подвижными электронами («электронным газом») (рис.17). При ударе металл не раскалывается подобно льду, алмазу или кристаллу соли, а лишь изменяет форму. Электроны благодаря своей подвижности успевают в момент удара переместиться и удержать ионы в новом положении. Именно поэтому металлы ковки и пластичны, легко изгибаются без разрушения. Кристаллическая решетка металла становится хрупкой только при очень низкой температуре, например при температуре жидкого азота (- 210 0С). Связано это с появлением некоторой доли ковалентно связанных атомов металла (рис. 25).
Рис. 25. Модель кристаллической решетки металла с некоторой долей ковалентных связей. Точками обозначены электроны
Модели возможных типов кристаллических решеток представлены на рис. 26.
Рис. 26. Модели кристаллических решеток (показана одна плоскость объемного кристалла): а) ковалентная или атомная; б) ионная; в) молекулярная; г) металлическая
Аморфные тела По разным причинам, например при быстрой кристаллизации жидкости (расплава), порядок расположения микрочастиц в узлах кристаллической решетки может нарушаться. Отсутствие упорядоченной кристаллической структуры характерно для твердых аморфных веществ. Аморфные вещества не имеют строго упорядоченной кристаллической структуры. Например, кварц SiO2, существует в кристаллическом и аморфном состояниях (рис. 27). В кристалле решетка имеет геометрически правильное строение в любой его части (рис. 27, а). В аморфном теле геометрически правильная решетка сохраняется в небольших по объему участках. Один из таких участков выделен пунктирной линией (рис. 27, б). По мере удаления от таких участков строгий порядок расположения атомов нарушается, т. е. отсутствует дальний порядок расположения атомов, нарушается трехмерная периодичность структуры, характерная для кристаллического состояния.
Рис. 27. Строение оксида кремния: а) кристаллического; б) аморфного. Черными кружками обозначены атомы кремния, светлыми – атомы кислорода. Изображена одна плоскость кристалла, поэтому четвертая связь у атома кремния не показана. Пунктирной линией выделен ближний порядок в беспорядке аморфного вещества
Жидкие кристаллы Индивидуальные кристаллические химические соединения плавятся при определенной постоянной температуре. Например, лед плавится при 00 С (р = 1 атм), и температура остается постоянной до тех пор, пока не расплавится весь кристалл льда. Для аморфных веществ не существует определенной постоянной температуры плавления. Это характерно для стекол и полимеров. Аморфное вещество постепенно размягчается, появляются капельки жидкости, но температурной остановки плавления не наблюдается. Существуют жидкие кристаллы – текучие вещества, молекулы которых частично упорядочены в одном направлении. По своим физико-химическим свойствам жидкие кристаллы занимают промежуточное положение между жидким и кристаллическим веществом. Известно, что жидкости изотропны, т.е. в декартовой системе координат оптические свойства, плотность вещества и многие другие свойства жидкости не меняются, не зависят от направления. Кристаллы представляют собой анизотропную среду, физические свойства которой различны в различных направлениях.
Жидкие кристаллы сохраняют некоторые свойства жидкостей, например текучесть. Но в отсутствие внешнего воздействия в жидких кристаллах анизотропны электропроводность, теплопроводность, оптические и другие характеристики, присущие твердым кристаллам. Такая особенность обусловлена молекулярной структурой соединений, составляющих жидкий кристалл. Одно из соединений такого типа представлено ниже:
4-пентил-4¢-цианодифенил Обозначим удлиненную молекулу жидкого кристалла прямой линией. Такие удлиненные молекулы стремятся выстроиться в определенном дальнем порядке, распространяющемся по всему объему (рис. 28).
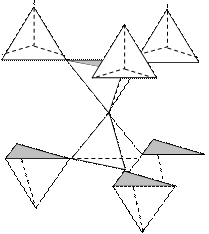
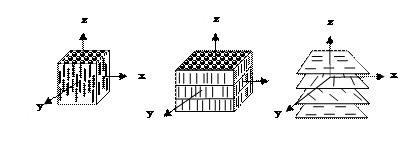
Рис. 28. Модели жидких кристаллов: а) нематическая; б) смектическая; в) холестерическая
В нематическом жидком кристалле молекулы проявляют упорядоченность – они ориентированы по оси Z, но, как в обычной жидкости, молекулы характеризуются хаотическим распределением центров тяжести. Такие жидкости выглядят как мутная непрозрачная жидкость. Под воздействием электрического поля напряжением порядка 1 В изменяется структура жидкого кристалла и его оптические свойства. В смектическом жидком кристалле молекулы расположены слоями, которые скользят относительно друг друга, проявляя текучесть, свойственную жидкости, однако по оси Z проявляются свойства твердого тела под воздействием внешнего давления. Холестерический жидкий кристалл в плоскости ХУ обладает текучестью подобно смектическому жидкому кристаллу. А вдоль оси Z молекулы в слоях изменяют свою ориентацию при переходе от слоя к слою по восходящей (или нисходящей) спирали. Жидкие кристаллы используются в термометрах, в электронных часах, микрокалькуляторах для отражения цифровой и буквенной информации и многих других приборах.
Жидкости и газы Жидкостиотличаются от кристаллических и аморфных тел хаотическим перемещением атомов, молекул или ионов. Так ведут себя расплавы металлов, жидкая вода, расплавы солей. В жидкостях силы притяжения в состоянии удерживать микрочастицы относительно друг друга на расстояниях, соизмеримых с расстояниями в твердом теле. Компактное размещение молекул жидкости при их подвижности обеспечивает высокую плотность и малую сжимаемость. Вода, например, имеет плотность выше, чем такие металлы, как натрий или калий, хотя плотность большей части металлов превосходит плотность воды и органических жидкостей. Свободное перемещение молекул жидкости позволяет молекулам совершать колебательное, вращательное, поступательное и деформационное движения, в то время как в кристалле движение частиц ограничено колебанием в узлах кристаллической решетки.
Плавление твердого тела есть следствие разрушения ионных, металлических связей или ослабления межмолекулярного взаимодействия в молекулярных кристаллах. Для того чтобы расплавить кристалл, требуется энергия, которая должна поступать от нагревателя. Газообразное состояние вещества характеризуется большими расстояниями между частицами (атомами и/или молекулами) по сравнению с расстояниями между частицами твердого тела или жидкости. Поэтому взаимодействие между частицами газа (притяжение и отталкивание) практически отсутствует. Хаотическое движение частиц позволяет молекулам газа занимать весь предоставленный им объем. Для жидкостей и твердых веществ это не характерно. Насколько взаимодействие между молекулами газа ослаблено по сравнению с взаимодействием в жидкостях, можно судить по таким расчетам: 1 моль жидкой воды при 100 0С занимает объем 18,7 см3, а 1 моль насыщенного пара воды при этой же температуре занимает объем 30 000 см3. Состояние идеального газа подчиняется уравнению: PV = n×RT. Идеальный газ – это предельное состояние реального газа при бесконечно малом давлении. Чем выше температура, тем ближе состояние реального газа к идеальному. Уравнение состояния идеального газа позволяет рассчитать объем V [м3], давление Р [Па] и температуру Т [К] для любого количества вещества n [моль], используя значение газовой постоянной R = 8,314 [Дж/моль×К]. Пример. В стеклянном сосуде объемом 1 л содержится газообразная вода при 1200 С. Давление газа равно 190 мм рт. ст. Сколько моль воды содержится в сосуде? Решение В соответствии с уравнением состояния идеального газа
1 атм = 760 мм рт. ст. = 1,013×105 Па; 1 мм рт. ст. = 133,3 Па n = 190×133,3 [Па] 1×10-3 [м3]/ 8,314 [Дж/моль К] 393 [К] = 7,75×10-3 моль
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 582; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.166.5 (0.012 с.) |