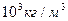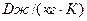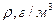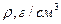Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Наблюдение за отвердеванием аморфного телаСодержание книги
Поиск на нашем сайте Оборудование: пробирка с белым веществом, лабораторный термометр, стакан с горячей водой, секундомер.
Содержание и метод выполнения работы Аморфные тела не имеют определенной температуры плавления. По мере нагревания они постепенно размягчаются, превращаясь в жидкость, все менее и менее вязкую. При охлаждении эта жидкость непрерывно увеличивает свою вязкость, пока не застынет в аморфно-твердое тело. Объясняется это особенностями строения этих тел. В аморфных телах молекулы расположены также беспорядочно, как и в жидкостях, и поэтому их переход в жидкое состояние и обратно не сопровождается изменением молекулярного строения вещества, а заключается только в непрерывном изменении подвижности молекул.
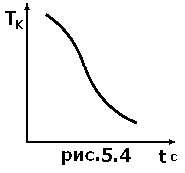
В том, что аморфные тела, в отличие от кристаллических, не имеют определенной температуры плавления и кристаллизации, можно убедиться, сравнивая графики изменения температуры со временем, полученные при наблюдении за охлаждением кристаллического и аморфного вещества (рис.5.4). Аморфное вещество в пробирке опускают в горячую воду. Когда оно достаточно прогреется, убеждаются в том, что в пробирке жидкость. В нее погружают термометр и помещают в стакан с теплой водой. Вода в стакане выполняет роль простейшего термостата и обеспечивает необходимую скорость охлаждения. С интервалом времени в одну минуту записывают показания термометра. Когда температура уменьшится до комнатной, пробирку достают и убеждаются в том, что вещество затвердело. Опыт прекращают. Строят график зависимости температуры вещества от времени и сравнивают его с графиком, полученном в упражнении 1. Убеждаются в отсутствии момента кристаллизации при переходе аморфного тела из жидкого состояния в твердое
Порядок выполнения работы 1. Для записи результатов измерений подготовьте таблицу:
2. Пробирку с белым веществом опустите в горячую воду и расплавьте его. 3. Убедитесь, что в пробирке находится жидкость. При наклоне пробирки в разные стороны видно, что форма вещества в ней меняется в зависимости от наклона, то есть не сохраняется, что и является отличием жидкости от твердых тел. 4. Отпустите пробирку с термометром внутри в стакан с теплой водой. 5. После того, как показания термометра установятся, начинайте регистрировать температуру с интервалом в одну минуту. 6. Когда температура опустится до 7. По данным измерений постройте зависимость температуры вещества в пробирке от времени желательно на том же графике, который был построен в первом упражнении. Сравните графики, построенные при выполнении упражнений 1 и 2. 8. С помощью графика докажите, что в пробирке находилось аморфное вещество. Упражнение 3 ИССЛЕДОВАНИЕ СВОЙСТВ ПЕРЕОХЛАЖДЕННОЙ ЖИДКОСТИ Оборудование: пробирка с розовым веществом (гипосульфит, салол, ванилин), лабораторный термометр, стеклянный стакан, секундомер.
Содержание и метод выполнения работы Если кристаллическое вещество, находящееся в жидком состоянии, охлаждать, то в момент, когда его температура опустится до температуры плавления, должна начинаться кристаллизация. Однако при достаточно быстром охлаждении жидкости кристаллизация не всегда успевает произойти, и вещество оказывается при температуре, которая ниже температуры плавления, сохраняя свое жидкое состояние. Это явление называют переохлаждением жидкости. В различных жидкостях переохлаждение достигается неодинаково легко. Некоторые жидкости могут переохлаждаться на десятки градусов ниже своей температуры кристаллизации, другие кристаллизуются уже при самом незначительном переохлаждении. Состояние переохлажденной жидкости неустойчиво, так же как состояние пересыщенного пара или перегретой жидкости. Некоторые жидкости в переохлажденном состоянии достаточно встряхнуть, чтобы вызвать быструю кристаллизацию. Переохлажденная жидкость может закристаллизоваться и при внесении в нее кристалла того же вещества. Если переохлажденная жидкость начинает кристаллизоваться, имея незначительный теплообмен с окружающими телами, то выделяющаяся при этом энергия нагревает образующуюся смесь из кристаллов и жидкости. При не слишком сильном переохлаждении, то есть когда температура жидкости на момент кристаллизации оказалась не на много ниже температуры плавления, выделяющаяся теплота может разогреть всю систему до температуры плавления, после чего темп кристаллизации замедлится и будет зависеть от того, с какой скоростью выделяющееся тепло станет поглощаться окружающими телами (рис.5.5). Целью работы является построение графика зависимости температуры вещества от времени, определение по нему температуры кристаллизации, наблюдение за ростом кристаллов в переохлажденной жидкости. Объектом изучения является розовое вещество в пробирке. Пробирку погружают наполовину в горячую воду температурой
Порядок выполнения работы 1. Для записи результатов измерений подготовьте таблицу:
2. Расплавьте вещество в пробирке со вставленным в нее термометром и поместите в стакан. 3. После того как показания термометра установятся, начинайте записывать его показания с интервалом 0,5 минут. 4. Когда температура опустится до 5. При образовании первых кристаллов обратите внимание на их количество и скорость роста. 6. Постройте график зависимости температуры вещества от времени. 7. По графику определите: а) температуру плавления вещества, б) продолжительность времени пребывания вещества в состоянии переохлажденной жидкости, в) продолжительность времени кристаллизации вещества. Контрольные вопросы 1.Что называется фазой, фазовым переходом? 2. Какие виды фазовых переходов существуют? 3. Как выглядит диаграмма состояния? 4. В чем отличие твердых тел от жидкостей и аморфных тел? 5. Поясните уравнение Клайперона – Клаузиуса. 6.Какое состояние вещества называют переохлажденной жидкостью? 7.Как вещество можно вывести из состояния переохлажденной жидкости? ЛИТЕРАТУРА 1. Грабовский Р.И. Курс физики. – СПб.: Лань, 2007. 2. Трофимова Т.И. Курс физики: Учебное пособие для вузов. –М.:Академия, 2007. 3. Лаврова И.В. Курс физики. – М.: Просвещение, 1981. 4. Сена Л.С. Единицы физических величин и их размерности. – М.: Наука,1977. 5. Эсаулова И.А., Блохина М.Е., Гонцов Л.Д. Руководство к лабораторным работам по физике. – М.: Высшая школа, 1983. ПРИЛОЖЕНИЯ
Таблица 1.Единицы и размерности физических величин
Таблица 2. Формулы определения погрешностей
Таблица 3.Основные физические константы
Таблица 4 Плотность некоторых твердых веществ при 200 С
Таблица 5. Коэффициенты трения скольжения различных материалов
Табл.6. Плотность газов (при нормальных условиях)
Таблица 7. Свойства некоторых жидкостей (при 200С)
Таблица 8. Зависимость давления и плотности насыщенного водяного пара от температуры
Таблица 9. Зависимость плотности воды от температуры
Таблица 10. Коэффициент внутреннего трения (вязкости) h некоторых жидкостей
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 561; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.141 (0.011 с.) |

 Таким образом, аморфно-твердое и жидкое состояние не представляют собой двух различных состояний вещества. Тело из аморфного вещества может формально соответствовать признакам, характерным для твердых тел – сохранять свою форму и объем, но являться при этом жидкостью, в которой подвижность молекул значительно снизилась из-за охлаждения.
Таким образом, аморфно-твердое и жидкое состояние не представляют собой двух различных состояний вещества. Тело из аморфного вещества может формально соответствовать признакам, характерным для твердых тел – сохранять свою форму и объем, но являться при этом жидкостью, в которой подвижность молекул значительно снизилась из-за охлаждения.
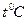
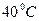 , выньте пробирку из стакана и, наклоняя ее в разные стороны, убедитесь, что вещество застыло.
, выньте пробирку из стакана и, наклоняя ее в разные стороны, убедитесь, что вещество застыло.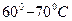 . Вещество быстро расплавится. Пробирку переносят в стакан без воды и с интервалом в 0,5 минут записывают его показания. Чтобы не вызвать преждевременной кристаллизации, пробирку надо предохранять от толчков. Когда температура опустится до
. Вещество быстро расплавится. Пробирку переносят в стакан без воды и с интервалом в 0,5 минут записывают его показания. Чтобы не вызвать преждевременной кристаллизации, пробирку надо предохранять от толчков. Когда температура опустится до 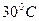 , термометр несколько раз поднимают и опускают внутри жидкости. Этого воздействия оказывается достаточно, чтобы начался процесс кристаллизации. Продолжая измерять температуру, наблюдают за образованием кристаллов. Опыт заканчивают после того, как вещество, закристаллизовавшись, начинает остывать как твердое тело.
, термометр несколько раз поднимают и опускают внутри жидкости. Этого воздействия оказывается достаточно, чтобы начался процесс кристаллизации. Продолжая измерять температуру, наблюдают за образованием кристаллов. Опыт заканчивают после того, как вещество, закристаллизовавшись, начинает остывать как твердое тело.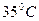 ,помешайте термометром жидкость в пробирке, не повредив его кончик.
,помешайте термометром жидкость в пробирке, не повредив его кончик. N=A+B+...
N=A+B+...
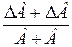
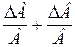
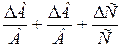
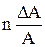
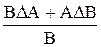
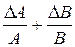
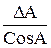
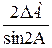
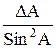
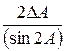
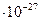 кг
кг