
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение газовой постоянной методом откачкиСодержание книги
Поиск на нашем сайте Оборудование: насос Камовского, стеклянный баллон с краном с известным объемом, весы технические, разновесы, пинцет, моновакуумметр, манометр.
Вопросы к допуску: 1. Какой газ называется идеальным? 2. Запишите уравнение Менделеева-Клапейрона. 3. Как определяется газовая постоянная в данной лабораторной работе? 4. Чему равно табличное значение газовой постоянной?
Содержание и метод выполнения работы В данной лабораторной работе с помощью простого опыта вам предстоит определить молярную (универсальную) газовую постоянную R и постоянную Больцмана k – две важнейшие физические константы, численные значения которых вы должны помнить из школьного курса. Постоянные R и k входят в уравнения газовых законов и уравнения термодинамики. Рассмотрим эти уравнения для простейшей системы – идеальный газ. Для определения постоянной R запишем уравнение для объема газа V в баллоне при комнатной температуре Т и атмосферном давлении Р 1 для массы М 1:
Если откачать насосом газ (в работе воздух) из баллона объема V до давления Р2, то уравнение Менделеева-Клапейрона запишется в виде:
Предполагаем, что после откачки части воздуха температура воздуха в баллоне равна комнатной температуре, т.е. Т1=Т2=Т. Вычтем из уравнения (1.1) уравнение (1.2) и найдем газовую постоянную:
В данной лабораторной работе газовая постоянная рассчитывается по этой формуле.
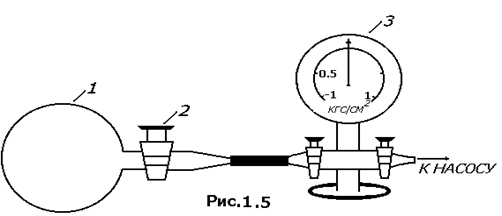
Установка для определения R изображена схематически на рис.1.5. Стеклянный баллон 1 присоединен к моновакуумметру 3 и дальше к насосу Камовского. Кран 2 служит для того, чтобы осуществлять связь баллона с атмосферой. Масса самого баллона с мешочком (при взвешивании мешочек не снимать) без учета находящегося внутри баллона воздуха: m б. Его объем равен (1,2 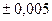 ) л. Молярная масса воздуха: ) л. Молярная масса воздуха: 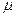 =29 10-3 кг/моль. =29 10-3 кг/моль.
Порядок выполнения работы:
1) Баллон с помощью резинового патрубка аккуратно присоединить к моновaкуумметру, соединенному с насосом Камовского. Открыть кран 2. 2) Откачать воздух до 3) Осторожно отсоединить баллон от моновакуумметра, подвесить к левой чашке весов и взвесить с точностью до сотых долей грамма массу баллона и воздуха внутри него т2. Масса воздуха в баллоне: М2=т2-тб. 4) Снять баллон с весов, осторожно открыть кран 2 (должно слышаться легкое шипение), впустить воздух в баллон. Тогда Р1=Ратм. 5) Снова взвесить баллон с воздухом, определить т1 с такой же точностью. Масса воздуха в баллоне М1=т1-тб. 6) Повторите измерения 3 раза. 7) Вычислите R по результатам различных измерений и найдите среднее значение. 8) Рассчитайте относительную погрешность по формуле:
9) Окончательный результат запишите в виде: 10) Определите постоянную Больцмана по среднему значению газовой постоянной по формуле:
11) Сравните полученные результаты с табличными данными. 12) По формуле: 13) По формуле: Контрольные вопросы
1. Какие величины вы будете определять в данной работе? 2. Каков физический смысл постоянных R, k и NА? В каких единицах они измеряются? 3. Сформулируйте законы идеального газа. 4. Почему для измерения R необходимо измерять массы воздуха в баллоне при различных давлениях? ЛАБОРАТОРНАЯ РАБОТА № 2 ЭКСПЕРИМЕНТАЛЬНАЯ ПРОВЕРКА ЗАКОНОВ ИДЕАЛЬНОГО ГАЗА Вопросы к допуску: 1. Какой газ называется идеальным? 2. Какие законы идеального газа проверяются в данной лабораторной работе? Каким образом? 3. Какое соотношение проверяется при изучении изотермического процесса? 4. Какое соотношение проверяется при изучении изобарического процесса? Упражнение1 ИССЛЕДОВАНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА
Оборудование: прозрачная трубка с кранами на концах (длина трубки 200 Цель работы: проверка соотношения между изменениями объема и давления определенного количества газа при его изотермическом сжатии. Содержание и метод выполнения работы В соответствии с законом Бойля – Мариотта соотношение между изменениями объема и давления определенного количества газа при его изотермическом сжатии должно иметь вид:
где Объектом изучения в данной лабораторной работе является воздух, находящийся внутри прозрачной трубки. В исходном состоянии он имеет следующие параметры: давление равно атмосферному, объем равен объему внутренней полости трубки, а температура соответствует температуре воздуха в лаборатории. Второе состояние получают путем сжатия воздуха в трубке. Для этого кран на одном конце трубки закрывают, а второй кран остается открытым. Конец трубки с открытым краном погружают в мерный цилиндр (до дна), который предварительно заполняют водой комнатной температуры, не долив до верхнего края 15-20 мм. Через открытый кран в трубку заходит вода и сжимает воздух. Таким образом, во втором состоянии параметры воздуха окажутся следующими: объем равен объему внутренней полости за вычетом объема воды, вошедшего в трубку, давление возрастет на величину гидростатического давления столба воды в цилиндре, температура не изменится. Объем внутренней полости определяется произведением площади поперечного сечения трубки на ее длину: V=SL. Подставим этосоотношение в уравнение Бойля – Мариотта: P1SL1 = P2SL2. Поскольку поперечное сечение трубки не меняется, в лабораторной работе проверяют соотношение: P1L1 = P2L2. В исходном состоянии давление P1 определяется по показаниям лабораторного барометра-анероида, а длина L1 измеряется измерительной лентой по длине столба воздуха во внутренней полости трубки. Для измерения давления во втором состоянии измеряют глубину погружения конца трубки в воду и измеряют разницу уровней воды в мерном цилиндре и в трубке –
Для определения объема воздуха во втором состоянии измеряют длину столба воды, вошедшей в трубку - 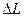 . Из измеренной ранее длины трубки вычитают длину столба воды, т.е. . Из измеренной ранее длины трубки вычитают длину столба воды, т.е. 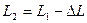 . .
Завершив измерения, находят произведения давления на объем воздуха в первом и втором состояниях. Сравнивая полученные числа, делают вывод о справедливости закона Бойля-Мариотта. Порядок выполнения работы 1. Подготовьте таблицу для записи результатов измерений и вычислений:
2. Измерьте длину воздушного столба в трубке – 3. Закройте один кран и погрузите конец трубки с открытым краном в мерный цилиндр (мензурку). 4. Измерьте длину столба воды, вошедшей в трубку – 5. Измерьте разницу уровней воды в мерном цилиндре и в трубке – 6. Вычислите длину воздушного столба в трубке после сжатия: 7. Вычислите гидростатическое давление воды 8. Вычислите давление воздуха в трубке после сжатия 9. Вычислите произведения 10. Укажите причины, повлиявшие на точность полученных результатов. Упражнение 2
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 466; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

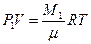 (1.1).
(1.1). . (1.2)
. (1.2)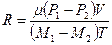 .
.
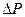 = 0,5 кг с/см2 и закрыть кран 2.
= 0,5 кг с/см2 и закрыть кран 2. .
.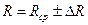 .
.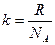 .
.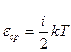 рассчитайте энергию одной молекулы воздуха при комнатной температуре
рассчитайте энергию одной молекулы воздуха при комнатной температуре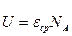 рассчитайте внутреннюю энергию одного моля воздуха (NA - число Авогадро).
рассчитайте внутреннюю энергию одного моля воздуха (NA - число Авогадро).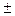 1 см), мерный цилиндр, измерительная лента.
1 см), мерный цилиндр, измерительная лента.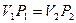 ,
, и
и  – объемы, занимаемые газом соответственно до и после сжатия, а
– объемы, занимаемые газом соответственно до и после сжатия, а 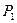 и
и 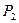 – его давления.
– его давления.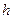 . Иными словами,
. Иными словами, 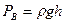 , где
, где 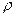 – плотность воды. Давление воздуха во втором состоянии будет равно сумме атмосферного
– плотность воды. Давление воздуха во втором состоянии будет равно сумме атмосферного 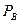 давлений.
давлений.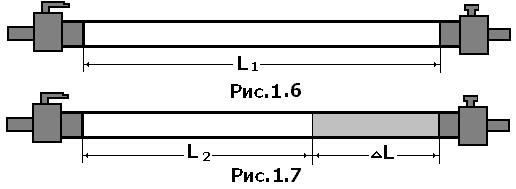
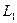 , мм
, мм
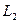 , мм
, мм
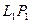
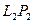
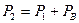 .
.


