
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение психрометрической постоянной аспирационным психрометромСодержание книги
Поиск на нашем сайте
Порядок выполнения работы 1. Осторожно с помощью специальной пипетки смачивают батист шарика влажного термометра. Заводят пружину вентилятора и продувают воздух через цилиндрические кожухи, в которых расположены термометры. 2. Снимают показания сухого и влажного термометров, когда между их показаниями установится определенная, не изменяющаяся разность температур. 3. Определяют атмосферное давление по барометру, находят в таблицах значение максимальной влажности при температуре влажного термометра Контрольные вопросы 1. Почему при смачивании ткани влажного термометра возникает разность температур между показаниями сухого и влажного термометров? 2. Как изменится влажность помещения, если при неизменной температуре сухого термометра разность показаний термометров увеличится? Уменьшится? 3. Какова разность температур сухого и влажного термометров, если воздух насыщен водяными парами? 4. В каком случае испарение с поверхности кожи и слизистых оболочек идет активнее: при относительной влажности 40% или 70%? 5. Какие существуют методы определения влажности кроме метода психрометра?
V. ФАЗОВЫЕ ПЕРЕХОДЫ
Фазой называются однородные макроскопические части системы, находящиеся в различных состояниях и отделенные друг от друга границей раздела. Если одновременно существуют две и более различных фаз вещества при данной температуре и давлении, соприкасаясь друг с другом, и при этом масса одной из фаз не растет за счет другой, то говорят о фазовом равновесии. Переход вещества из одного фазового состояния в другое называется фазовым переходом, или фазовым превращением. Число фаз
Равновесие двух фаз может иметь место лишь в определенном интервале температур, причем каждому значению температуры
Различают фазовые переходы двух родов. Фазовый переход первогорода (например, плавление, кристаллизация и т.д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазовогоперехода. Фазовые переходы первого рода характеризуются постоянством температуры, изменениями энтропии и объема. Например, при плавлении телу надо сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решетки. Подводимая при плавлении теплота идет не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. В подобных переходах – из более упорядоченного кристаллического состояния в менее упорядоченное состояние – степень беспорядка увеличивается, т.е. согласно второму началу термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система выделяет теплоту. Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами второгорода. Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Фазовые переходы второго рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов второго рода являются: переход ферромагнитных веществ (железа, никеля) при определенном давлении и температуре в парамагнитное состояние. Одно и то же вещество в зависимости от соотношения между удвоенной средней энергией, приходящейся на одну степень свободы хаотического (теплового) движения молекул и наименьшей потенциальной энергией взаимодействия молекул может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями – температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления. Для наглядного изображения фазовых превращений используется диаграмма состояния (рис.5.2), на которой в координатах Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП – твердого тела и жидкости, КИ – жидкости и газа, КС – твердого тела и газа. Точка, в которой пересекаются эти кривые и которая, следовательно, определяет условия (температуру Термодинамика дает метод расчета кривой равновесия двух фаз одного и того же вещества. Согласно уравнению Клапейрона – Клаузиуса производная от равновесного давления по температуре равна:
где Уравнение Клайперона – Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку ЛАБОРАТОРНАЯ РАБОТА №8
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 134; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.34.218 (0.011 с.) |

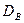 и подставляя в формулу (4.7) находят психрометрическую постоянную
и подставляя в формулу (4.7) находят психрометрическую постоянную  . Для вычисления
. Для вычисления 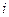 , могущих быть в равновесии друг с другом, определяется правилом фаз Гиббса
, могущих быть в равновесии друг с другом, определяется правилом фаз Гиббса  и зависит от числа компонент
и зависит от числа компонент  в веществе.
в веществе.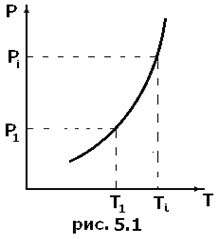 В учении о фазах основным вопросом является выяснение условий равновесия нескольких фаз. Условия равновесия фаз включают механическое и тепловое равновесия. Тепловое равновесие нескольких фаз наступит тогда, когда все фазы системы имеют одну и ту же температуру (т.е.
В учении о фазах основным вопросом является выяснение условий равновесия нескольких фаз. Условия равновесия фаз включают механическое и тепловое равновесия. Тепловое равновесие нескольких фаз наступит тогда, когда все фазы системы имеют одну и ту же температуру (т.е.  , где
, где  число фаз). Для механического же равновесия необходимо равенство давлений по разные стороны границы раздела соприкасающихся фаз (т.е.
число фаз). Для механического же равновесия необходимо равенство давлений по разные стороны границы раздела соприкасающихся фаз (т.е. 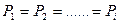 ). Равенство давлений и температур дает равенство фаз из разных не взаимопревращающихся веществ. В случае фаз из одинакового вещества должно выполняться еще одно условие: равновесие по отношению к фазовым переходам. Для равновесия фаз ни одна фаза не должна расти за счет других фаз из-за фазового превращения. Это условие будет выполняться при равновесии химических потенциалов соприкасающихся фаз (
). Равенство давлений и температур дает равенство фаз из разных не взаимопревращающихся веществ. В случае фаз из одинакового вещества должно выполняться еще одно условие: равновесие по отношению к фазовым переходам. Для равновесия фаз ни одна фаза не должна расти за счет других фаз из-за фазового превращения. Это условие будет выполняться при равновесии химических потенциалов соприкасающихся фаз (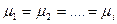 ). Нужно отметить, что равновесие фаз – это динамическое равновесие. При равновесии взаимопревращения фаз не прекращаются, наоборот, они становится еще более интенсивными. Но взаимопревращения фаз происходят таким образом, что переход одной фазы в другую полностью компенсируется обратным переходом, так что объемы соприкасающихся фаз не меняются.
). Нужно отметить, что равновесие фаз – это динамическое равновесие. При равновесии взаимопревращения фаз не прекращаются, наоборот, они становится еще более интенсивными. Но взаимопревращения фаз происходят таким образом, что переход одной фазы в другую полностью компенсируется обратным переходом, так что объемы соприкасающихся фаз не меняются. соответствует вполне определенное давление
соответствует вполне определенное давление  , при котором возможно равновесие.
, при котором возможно равновесие.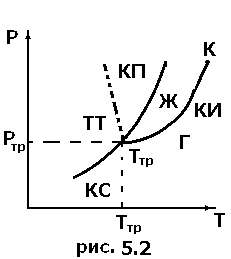 Состояние равновесия двух фаз на диаграмме (
Состояние равновесия двух фаз на диаграмме (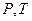 ) изображается кривой, выражающей функциональную связь
) изображается кривой, выражающей функциональную связь 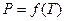 (рис.5.1). Равновесие фаз будет только при таких
(рис.5.1). Равновесие фаз будет только при таких  и
и 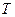 ,точки которых лежат на самой кривой. Правее и левее этой кривой вещество будет находиться в различных однофазных состояниях. Кривая, точки которой соответствуют равновесию фаз, называется фазовой диаграммой, или кривой равновесия фаз. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).
,точки которых лежат на самой кривой. Правее и левее этой кривой вещество будет находиться в различных однофазных состояниях. Кривая, точки которой соответствуют равновесию фаз, называется фазовой диаграммой, или кривой равновесия фаз. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую). и соответствующее ей равновесное давление
и соответствующее ей равновесное давление 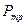 ) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой.
) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой. , (5.1)
, (5.1)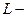 теплота фазового перехода,
теплота фазового перехода, 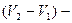 изменение объема вещества при переходе из первой фазы во вторую,
изменение объема вещества при переходе из первой фазы во вторую, 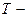 температура перехода (процесс изотермический).
температура перехода (процесс изотермический). и
и  . При испарении жидкостей и сублимации твердых тел объем вещества всегда возрастает, поэтому. Согласно (5.1).
. При испарении жидкостей и сублимации твердых тел объем вещества всегда возрастает, поэтому. Согласно (5.1). 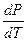 >0, следовательно, в этих процессах повышение температуры приводит к увеличению давления, и наоборот. При плавлении большинства веществ объем, как правило, возрастает, т.е.
>0, следовательно, в этих процессах повышение температуры приводит к увеличению давления, и наоборот. При плавлении большинства веществ объем, как правило, возрастает, т.е.  и др.) объем жидкой фазы меньше объема твердой фазы т.е.
и др.) объем жидкой фазы меньше объема твердой фазы т.е. 


