
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диаграмма состояния сплавов, компоненты которых полностью растворимы в жидком и твердом состояниях.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Металлический тип связи. Общность первых четырех свойств металлов обусловлена особым типом межатомной связи, называемой металлической связью. Известно, что атом состоит из положительного ядра и отрицательных частиц — электронов. Внешние (валентные) электроны металлов в отличие от неметаллов слабо связаны с ядром. Поэтому атомы металлов легко теряют валентные электроны, превращаясь в ионы, в освободившиеся электроны образуют так называемый электронный газ. Металлическая межатомная связь не имеет направленного характера. Электроны электронного газа не связаны с отдельными атомами, а в одинаковой степени принадлежат всем ионам металла. Металл состоит из правильно расположенных в пространстве ионов и легко перемещающихся среди них обобщенных электронов. Наличие металлической связи и легкоподвижных коллективизированных электронов объясняет характерные свойства металлов. Атомно-кристаллическое строение металлов и сплавов. Вещество в твердом состоянии может иметь кристаллическое или аморфное строение. В аморфном веществе, например стекле, атомы расположены беспорядочно, а в кристаллическом — по геометрически правильной схеме, на определенном расстоянии друг от друга. Общим свойством металлов и сплавов является их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах. Атомно-кристаллическая структура может быть представлена изображением не ряда периодически повторяющихся объемов, а с одной элементарной ячейкой. Элементарной ячейкой называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла. Основные типы кристаллических решеток. Наиболее часто металлы имеют кристаллические решетки следующих типов: Кубическая объемно-центрированная или сокращенно ОЦК (свинец, вольфрам) 9 атомов; Кубическая гранецентрированная (ГЦК) (серебро, золото) 14 атомов; гексагональная плотно-упакованная (ГПУ) (магний, цинк). Решетки ГЦК и ГПУ более компактны, чем ОЦК.
Полиморфизм металлов. Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку. Способность металла существовать в различных кристаллических формах носит название полиморфизма или аллотропии. Известны полиморфные превращения железа, титана и других элементов. Температура превращения одной кристаллической модификации в другую называется температурой полиморфного превращения. При полиморфном превращении меняется форма и тип кристаллической решетки. Это явление называется перекристаллизацией. α,β,γ,δ –обозначение полиморфных превращений (модификации). Тα (титан α)↔ Тβ (титан β) при тем-ре 882. Полиморфные превращения сопровождаются скачкообразными изменениями свойств Ме: удельный объем, теплопроводность, электрическая проводимость, мех-е св-ва, физ-е св-ва. При температурах ниже 911 °С устойчиво Feα, имеющее кристаллическую решетку ОЦК. Выше 911 °С до 1392 °С устойчиво Feγ, имеющее решетку ГЦК. При нагреве выше 911 °С атомы решетки ОЦК перестраиваются, образуя решетку ГЦК. На явлении полиморфизма основана термическая обработка.
Дефекты кристаллического строения, их влияния на свойства металлов. В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают следующие структурные несовершенства: • точечные (нульмерные)- малые во всех трех измерениях; • линейные (одномерные) - малые в двух измерениях и сколь угодно протяженные в третьем; • поверхностные (двухмерные) - малые в одном измерении. Точеные дефекты Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей. Вакансия - отсутствие атомов в узлах кристаллической решетки, «дырки», которые образовались в результате различных причин. Образуется при переходе атомов с поверхности в окружающую среду или из узлов решетки на поверхность (границы зерен, пустоты, трещины и т. д.), в результате пластической деформации, при бомбардировке тела атомами или частицами высоких энергий (облучение в циклотроне или нейтронной облучение в ядерном реакторе). Концентрация вакансий в значительной степени определяется температурой тела. Перемещаясь по кристаллу, одиночные вакансии могут встречаться. И объединяться в дивакансии. Скопление многих вакансий может привести к образованию пор и пустот. Точечные дефекты искажают кристаллическую решетку и ухудшают св-ва Ме.
Линейные дефекты Основными линейными дефектами являются дислокации. Дислокация - это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Дислокации облегчают пластическую деформацию. Поверхностные дефекты - границы зерен, фрагментов и блоков Размеры зерен составляют до 1000 мкм. Углы разориентации составляют до нескольких десятков градусов). Граница между зернами представляет собой тонкую в 5 - 10 атомных диаметров поверхностную зону с максимальным нарушением порядка в расположении атомов. Строение переходного слоя способствует скоплению в нем дислокаций. На границах зерен повышена концентрация примесей, которые понижают поверхностную энергию. Однако и внутри зерна никогда не наблюдается идеального строения кристаллической решетки. Имеются участки, разориентированные один относительно другого на несколько градусов Эти участки называются фрагментами. Процесс деления зерен на фрагменты называется фрагментацией или полигонизацией. В свою очередь каждый фрагмент состоит из блоков, разориентированных на угол менее одного градуса. Такую структуру называют блочной или мозаичной. Анизотропия – различие св-в в зависимости от направления испытания. Присутствие вакансий объясняет возможность диффузии — перемещения атомов на расстояния, превышающие средние межатомные расстояния для данного металла. Перемещение атомов осуществляется путем обмена местами с вакансиями. Различают самодиффузию и гетеродиффузию. В первом случае перемещения атомов не изменяют их концентрацию в отдельных объемах, во втором — сопровождаются изменением концентрации. Гетеродиффузия характерна для сплавов с повышенным содержанием примесей.
Кристаллизация металлов. Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии. Кристаллизация – переход Ме из жидкого состояния в твердое с образованием кристаллической решетки. Энергетические условия процесса кристаллизации. С изменением внешних условий свободная энергия G изменяется по сложному закону различно для жидкого и кристаллического состояний. Выше температуры Ts вещество должно находиться в жидком состоянии, а ниже Ts - в твердом. При температуре равной Ts жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура Ts (Тпл)- равновесная или теоретическая температура кристаллизации. Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры Ts Температура, при которой практически начинается кристаллизация называется фактической температурой кристаллизации (Тк).
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением, которое характеризуется степенью переохлаждения ΔТ = Тпл - Тк.Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждени). Кристаллизация - это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии. Механизм кристаллизации металлов: При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики - центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется. Минимальный размер способного к росту зародыша называется критическим размером, а зародыш - устойчивым. Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость - кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию. Чем больше степень переохлаждения, тем меньше критический размер зародыша и больше число зародышей способно к росту. Чем меньше зерна Ме, тем лучше мех-е св-ва. Строение металлического слитка. 3 зоны. 1мелкокристаллическая корковая зона; 2зона столбчатых кристаллов; 3внутренняя зона крупных равноосных кристаллов. Кристаллизация корковой зоны идет в условиях максимального переохлаждения. Скорость кристаллизации определяется большим числом центров кристаллизации.Образуется мелкозернистая структура. Жидкий металл под корковой зоной находится в условиях меньшего переохлаждения. Число центров ограничено и процесс кристаллизации реализуется за счет их интенсивного роста до большого размера.
Рост кристаллов во второй зоне имеет направленный характер. Они растут перпендикулярно стенкам изложницы, образуются древовидные кристаллы – дендриты. Растут дендриты с направлением, близким к направлению теплоотвода. Так как теплоотвод от незакристаллизовавшегося металла в середине слитка в разные стороны выравнивается, то в центральной зоне образуются крупные дендриты со случайной ориентацией. Зоны столбчатых кристаллов в процессе кристаллизации стыкуются, это явление называется транскристаллизацией. Для малопластичных металлов и для сталей это явление нежелательное, так как при последующей прокатке, ковке могут образовываться трещины в зоне стыка. В верхней части слитка образуется усадочная раковина, которая подлежит отрезке и переплавке, так как металл более рыхлый (около 15...20 % от длины слитка) Методы исследования металлов: структурные и физические Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа.
Система – группа тел выделяемых для наблюдения и изучения. В металловедении системами являются металлы и металлические сплавы. Чистый металл является простой однокомпонентной системой, сплав – сложной системой, состоящей из двух и более компонентов. Компоненты – вещества, образующие систему. В качестве компонентов выступают чистые вещества и химические соединения, если они не диссоциируют на составные части в исследуемом интервале температур. Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Механические свойства металлов и сплавов. Механическими наз-ся св-ва которые определяют поведение материала под действием внешних нагрузок. Классификация мех-х испытаний: 1-по скорости нагружения: статистические (V<=3м/мин) и динамические (V>3м/мин), 2- по тем-ре испытаний: нормальные Т=18-23°С, критичные Т<0, специальные Т>200, 3- по длительности процесса испытания: кратковременные, длительные, 4- по способу нагружения: растяжение, сжатие, изгиб, кручение, срез. Основные мех-е св-ва: Прочность – способность материала не разрушатся под действием приложенных к нему внешних сил. Пластичность –– способность материала получить остаточные изменения формы и размеров без разрушения. Твердость – способность материала сопротивляться внедрению в него другого более твердого тела. Ударная вязкость – степень сопротивления материала разрушению при ударной нагрузке. Строение сплавов. Под сплавом понимают вещество, полученное сплавлением или спеканием двух или более Ме или Ме с неМе. Сплавы плавятся и кристаллизуются в интервале тем-р. В-ва составляющие сплав наз-ся – компоненты. Совокупность сплавов данных компонентов наз-ся система. Fe-C – сплавы система железо-углерод, Cu-Sn – медь –олово, Cu-As – медь-мышьяк.
Основные фазы, возникающие в металлических сплавах. В сплавах образуются фазы – это обособленная, однородная часть системы, отличающаяся одинаковым составом, строением и св-вами. Фазы: чистые компоненты, жидкие р-ры, твердые р-ры, химические соединения.
Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры. Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа. В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура. Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4). По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава. Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы (С). Это правило фаз или закон Гиббса Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры. Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов). а). Определение состава фаз в точке m: Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус. Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации. Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации. Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса. С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В. б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m): Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды. Рассмотрим проведенную через точку m коноду и ее отрезки. Количество всего сплава (Qсп) определяется отрезком pq. Отрезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы.
Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы.
10. Диаграмма растяжения Ме. При статическом испытании на растяжение: ГОСТ 1497 получают характеристики прочности и пластичности. Прочность – способность материала сопротивляться деформациям и разрушению. Испытания проводятся на специальных машинах, которые записывают диаграмму растяжения, выражающую зависимость удлинения образца (мм) от действующей нагрузки Р, т.е.. Но для получения данных по механическим свойствам перестраивают: зависимость относительного удлинения от напряжения
Основными механическими свойствами являются прочность, упругость, вязкость, твердость. Зная механические свойства, конструктор обоснованно выбирает соответствующий материал, обеспечивающий надежность и долговечность конструкций при их минимальной массе. Механические свойства определяют поведение материала при деформации и разрушении от действия внешних нагрузок. В зависимости от условий нагружения механические свойства могут определяться при: 1. статическом нагружении – нагрузка на образец возрастает медленно и плавно. 2. динамическом нагружении – нагрузка возрастает с большой скоростью, имеет ударный характер. 3. повторно, переменном или циклическим нагружении – нагрузка в процессе испытания многократно изменяется по величине или по величине и направлению. Предел текучести характеризует сопротивление материала небольшим пластическим деформациям. Предел прочности – напряжение, соответствующее максимальной нагрузке, которую выдерживает образец до разрушения (временное сопротивление разрыву). Пластичность –– способность материала к пластической деформации, т.е. способность получать остаточное изменение формы и размеров без нарушения сплошности.
12. Превращение в сплавах железо-цементит.
В системе железо-цементит (Fe - Fе3С) имеются следующие фазы: жидкий раствор. твердые растворы- феррит и аустенит, а также химическое соединение - цементит. Аустенит g-Fe - твердый раствор углерода в g-железе. Предельная растворимость углерода в g-железе 2,14%. Он устойчив только при высоких температурах, а с некоторым примесями (Мn, Сг и др.) при обычных (даже низких) температурах. Аустенит обладает высокой пластичностью, низкими пределами текучести и прочности. Твердость аустенита 160...200 НВ. Цементит Fе3С - химическое соединение железа с углеродом, содержащее 6,67% vглерода. Температура плавления ~1250°С. Время его устойчивости уменьшается с повышением температуры: при низких температурах он существует бесконечно долго, а при температурах, превышающих 950°С, за несколько часов распадается на железо и графит. Цементит имеет точку Кюри (210°С) и обладает сравнительно высокими твердостью (800 НВ и выше) и хрупкостью. Ледебурит – двухфазная структура, эвтектическая смесь аустенита и цементита с содержанием углерода 4,3%, продукт кристаллизации жидкого сплава при т=1147. Перлит - двухфазная структура, эвтектоидная смесь феррита и цементита пластинчатого строения с содержанием С- 0,83%, продукт распада аустенита при т=727. Линия ABCD - линия начала кристаллизации сплава (ликвидус), линия AECF - линия конца кристаллизации сплава (солидус).ECF-линия эвтектического превращения, EC-линия ограниченной растворимости С в А, GSGP-линия полиморфного превращения, PSK-линия эвтектоидного превращения, PQ-линия ограниченной растворимости С в феррите. • стали - до 2,14% С, не содержат ледебурита;• чугуны - более 2,14%С, содержат ледебурит.В зависимости от содержания углерода (%) железоуглеродистые сплавы получили следующие названия:• менее 0,83 - доэвтектоидные стали;• 0,83 - эвтектоидные стали;• 0,83...2 - заэвтектоидные стали; • 2...4,3 - доэвтектические чугуны;• 4,3...6,67 - заэвтектические чугуны. Другой источник: Любая разновидность термической обработки состоит из комбинации четырех основных превращений, в основе которых лежат стремления системы к минимуму свободной энергии 1. Превращение перлита в аустенит
4. Превращение мартенсита в перлит
Углеродистые стали.
Углеродистые стали - Fe – основа, С <= 1,3%. Примеси а) полезные Mn<0,7% -вводят специально как раскислитель. Повышает плотность на снижая пластичность и вязкость. Si<0,5%- вводят специально как раскислитель.б) вредные S<0,06%-присутствует в виде FeS и обеспечивает красноломкость стали-потеря пластичности при горячей обрадотки Ме давлением(800-1200оС). P<0,06%-обеспечивает хладноломкость-потеря пластичности при комнатной тем-ре. N<0,02…0,002% и O<0,02…0,002%. Нитриды и оксиды повышают прочность, но снижают вязкость за счет увеличения порога хладноломкости H<0,001…0,0007%. в) Cu Cr Ti Ni- случайные. Чем больше С, тем больше твердость, меньше пластичность и вязкость. Чем меньше С, тем больше цементита, который отличается высокой твердостью и очень высокой хрупкостью. Плотность с увеличением содержания С возрастает, достигая максимума при 0,8-0,9% С, затем падает. Падение прочности обусловлено образованием цементитной сетки. Стали классифицируются по множеству признаков. 1. По химическому: составу: углеродистые и легированные. 2. По содержанию углерода: o низкоуглеродистые, с содержанием углерода до 0,25 %; o среднеуглеродистые, с содержанием углерода 0,3…0,6 %; o высокоуглеродистые, с содержанием углерода выше 0,7 % 3. По равновесной структуре: доэвтектоидные, эвтектоидные, заэвтектоидные. 4. По качеству. Количественным показателем качества является содержания вредных примесей: серы и фосфора: o, – углеродистые стали обыкновенного качества: o – качественные стали; o – высококачественные стали. 5. По способу выплавки: o в мартеновских печах; o в кислородных конверторах; o в электрических печах: электродуговых, индукционных и др. 6. По назначению: o конструкционные – применяются для изготовления деталей машин и механизмов; o инструментальные – применяются для изготовления различных инструментов; o специальные – стали с особыми свойствами: электротехнические, с особыми магнитными свойствами и др. Углеродистые стали обыкновенного качества (ГОСТ 380).
Стали содержат повышенное количество серы и фосфора Маркируются Ст.2кп., БСт.3кп, ВСт.3пс, ВСт.4сп. Ст – индекс данной группы стали. Цифры от 0 до 6 - это условный номер марки стали. С увеличением номера марки возрастает прочность и снижается пластичность стали. По гарантиям при поставке существует три группы сталей: А, Б и В. Для сталей группы А при поставке гарантируются механические свойства, в обозначении индекс группы А не указывается. Для сталей группы Б гарантируется химический состав. Для сталей группы В при поставке гарантируются и механические свойства, и химический состав. Индексы кп, пс, сп указывают степень раскисленности стали: кп - кипящая, пс - полуспокойная, сп - спокойная.
Качественные углеродистые стали Качественные стали поставляют с гарантированными механическими свойствами и химическим составом (группа В). Степень раскисленности, в основном, спокойная. Конструкционные качественные углеродистые стали Маркируются двухзначным числом, указывающим среднее содержание углерода в сотых долях процента. Указывается степень раскисленности, если она отличается от спокойной. Сталь 08 кп, сталь 10 пс, сталь 45. Содержание углерода, соответственно, 0,08 %, 0,10 %, 0.45 %. Инструментальные качественные углеродистые стали маркируются буквой У (углеродистая инструментальная сталь) и числом, указывающим содержание углерода в десятых долях процента. Сталь У8, сталь У13. Содержание углерода, соответственно, 0,8 % и 1,3 % Инструментальные высококачественные углеродистые стали. Маркируются аналогично качественным инструментальным углеродистым сталям, только в конце марки ставят букву А, для обозначения высокого качества стали. Сталь У10А.
Качественные и высококачественные легированные стали Обозначение буквенно-цифровое. Легирующие элементы имеют условные обозначения, Обозначаются буквами русского алфавита. Обозначения легирующих элементов: Х – хром, Н – никель, М – молибден, В – вольфрам, К – кобальт, Т – титан, А – азот (указывается в середине марки), Г – марганец, Д – медь, Ф – ванадий, С – кремний, П – фосфор, Р – бор, Б – ниобий, Ц – цирконий, Ю – алюминий
Легированные конструкционные стали Сталь 15Х25Н19ВС2 В начале марки указывается двухзначное число, показывающее содержание углерода в сотых долях процента. Далее перечисляются легирующие элементы. Число, следующее за условным обозначение элемента, показывает его содержание в процентах, Если число не стоит, то содержание элемента не превышает 1,5 %. В указанной марке стали содержится 0,15 % углерода, 25% хрома, 19 % никеля, до 1,5% вольфрама, до 2 % кремния. Для обозначения высококачественных легированных сталей в конце марки указывается символ А.
Легированные инструментальные стали Сталь 9ХС, сталь ХВГ. В начале марки указывается однозначное число, показывающее содержание углерода в десятых долях процента. При содержании углерода более 1 %, число не указывается, Далее перечисляются легирующие элементы, с указанием их содержания. Некоторые стали имеют нестандартные обозначения.
Серый и белый чугун. Fe-C где С > 2% - Низкя прочность, - низкя пластичность,
- чугуны дешевле сталей. С в группах может находится в виде: Ц – цементита, Гр – графита, Ц+Гр – графита и цементита. В зависимости от вида присутствия углерода, различают: Белые, серые, ковкие, высокопрочные. а). Белый чугун. Весь углерод присутствует в виде цементита. Из белого чугуна можно получить серый чугун с помощью графитизации - процесс выделения углерода в виде графита при кристаллизации или охлаждении сплава. б). Серый чугун. Графит в пластинчатой форме. Ф+Гр серый ферритный, П+Гр серый перлитный, Ф+П+Гр серый феритно-перлитный. Ферритный применяют для слабо- и средне- нагруженных деталей. Феритно-перлитный для деталей работающих при саттических нагрузках и динамических. Перлитный при высоких нагрузках или в тяжелых условиях износа. Свойства серых чугунов: - низкие прочность и пластичность, - хорошо обрабатываются резаньем, - хорошие литейные свойства, - хорошие антифрикционные свойства, С415, С420. = 150 МПа в). Высоко-прочный чугун. Графит свернулся в шарики(из-за ввода Mg в небольших количествах) Mg = 0,02 – 0,08%. Ф=Гр; П+Гр; Ф+П+Гр. В438 – 1,7 S = 1,7%(пластичность).(высокопрочный чугун), с прочностью = 380 МПа Применение: для деталей работающих при высоких циклических нагрузках и в условиях изаншивания. г). Ковкий чугун. К4 Ф+Гр, П+Гр. Применение: для изготовления деталей высокой прочности, воспринимающих ударные и знакопеременные нагрузки. К430-6.
16. Чугуны с шаровидным графитом. Высокопрочный чугун с шаровидным графитом. Высокопрочные чугуны (ГОСТ 7293) могут иметь ферритную (ВЧ 35), феррито-перлитную (ВЧ45) и перлитную (ВЧ 80) металлическую основу. Получают эти чугуны из серых, в результате модифицирования магнием или церием (добавляется 0,03…0,07% от массы отливки). По сравнению с серыми чугунами, механические свойства повышаются, это вызвано отсутствием неравномерности в распределении напряжений из-за шаровидной формы графита. Чугуны с перлитной металлической основой имеют высокие показатели прочности при меньшем значении пластичности. Соотношение пластичности и прочности ферритных чугунов - обратное. Высокопрочные чугуны обладают высоким пределом текучести,что выше предела текучести стальных отливок. Также характерна достаточно высокая ударная вязкость и усталостная прочность,при перлитной основе. Высокопрочные чугуны содержат: углерода – 3,2…3,8 %, кремния – 1,9…2,6 %, марганца – 0,6…0,8 %, фосфора – до 0,12 %, серы – до 0,3 %. Эти чугуны обладают высокой жидкотекучестью, линейная усадка – около 1%. Литейные напряжения в отливках несколько выше, чем для серого чугуна. Из-за высокого модуля упругости достаточно высокая обрабатываемость резанием. Обладают удовлетворительной свариваемостью. Из высокопрочного чугуна изготовляют тонкостенные отливки (поршневые кольца), шаботы ковочных молотов, станины и рамы прессов и прокатных станов, изложницы, резцедержатели, планшайбы. Отливки коленчатых валов массой до 2..3 т, взамен кованых валов из стали, обладают более высокой циклической вязкостью, малочувствительны к внешним концентраторам напряжения, обладают лучшими антифрикционными свойствами и значительно дешевле. Обозначаются индексом ВЧ (высокопрочный чугун) и числом, которое показывает значение предела прочности, умноженное на ВЧ 100.
Литейные сплавы. 1. Конструкционные герметичные Не упрочняемые ТО Al-Si Упрочняемые ТО Al-Si-Mg (силумин) АЛ2, АЛ4, АЛ34. 2. Высокопрочные и жаропрочные Al-Cu-Mn, Al-Cu-Mn-Ni 3. коррозионностойкие Al-Mg
40. Деформируемые алюминиевые. ,5% Al = 2,7 г/см; Т = 660 С; ГЦК. Коррозионная стойкость, теплопроводность, электропроводность, пластичность. Cu, Zn, Mg, Ni, Fe повышают прочность Al. Mn повышают коррозионную стойкость. Ni, Ti, Cr, Fe повышают жаропрочность. Si образуют эвтектику. Классификация алюминиевых сплавов. По технологии производства деталей: - деформированные - литейные По способности упрочнятся термической обработкой: - упрочняемые - неупрочняемые Д – деформируемые Л – литейные I – неупрочняются ТО II – упрочняются ТО Поверхностная закалка Конструкционная прочность часто зависит от состояния материала в поверхностных слоях детали. Одним из способов поверхностного упрочнения стальных деталей является поверхностная закалка. В результате поверхностной закалки увеличивается твердость поверхностных слоев изделия с одновременным повышением сопротивления истиранию и предела выносливости. Общим для всех видов поверхностной закалки является нагрев поверхностного слоя детали до температуры закалки с последующим быстрым охлаждением. Эти способы различаются методами нагрева деталей. Толщина закаленного слоя при поверхностной закалке определяется глубиной нагрева. Наибольшее распространение имеют электротермическая закалка с нагревом изделий токами высокой частоты (ТВЧ) и газопламенная закалка с нагревом газово-кислородным или кислородно-керосиновым пламенем.
Металлический тип связи. Общность первых четырех свойств металлов обусловлена особым типом межатомной связи, называемой металлической связью. Известно, что атом состоит из положительного ядра и отрицательных частиц — электронов. Внешние (валентные) электроны металлов в отличие от неметаллов слабо связаны с ядром. Поэтому атомы металлов легко теряют валентные электроны, превращаясь в ионы, в освободившиеся электроны образуют так называемый электронный газ. Металлическая межатомная связь не имеет направленного характера. Электроны электронного газа не связаны с отдельными атомами, а в одинаковой степени принадлежат всем ионам металла. Металл состоит из правильно расположенных в пространстве ионов и легко перемещающихся среди них обобщенных электронов. Наличие металлической связи и легкоподвижных коллективизированных электронов объясняет характерные свойства металлов. Атомно-кристаллическое строение металлов и сплавов. Вещество в твердом состоянии может иметь кристаллическое или аморфное строение. В аморфном веществе, например стекле, атомы расположены беспорядочно, а в кристаллическом — по геометрически правильной схеме, на определенном расстоянии друг от друга. Общим свойством металлов и сплавов является их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах. Атомно-кристаллическая структура может быть представлена изображением не ряда периодически повторяющихся объемов, а с одной элементарной ячейкой. Элементарной ячейкой называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла. Основные типы кристаллических решеток. Наиболее часто металлы имеют кристаллические решетки следующих типов: Кубическая объемно-центрированная или сокращенно ОЦК (свинец, вольфрам) 9 атомов; Кубическая гранецент
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 560; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.110.45 (0.021 с.) |




 Равновесное состояние железоуглеродистых сплавов в зависимости от содержания углерода и температуры описывает диаграмма состояния железо - углерод. На диаграмме состояния железоуглеродистых сплавов (рис. 1) на оси ординат отложена температура, на оси абсцисс - содержание в сплавах углерода до 6,67%, то есть до такого количества, при котором образуется цементит Fе3С. По диаграмме состояния системы железо - углерод судят о структуре медленно охлажденных сплавов, а также о возможности изменения их микроструктуры в результате термической обработки, определяющей эксплуатационные свойства.
Равновесное состояние железоуглеродистых сплавов в зависимости от содержания углерода и температуры описывает диаграмма состояния железо - углерод. На диаграмме состояния железоуглеродистых сплавов (рис. 1) на оси ординат отложена температура, на оси абсцисс - содержание в сплавах углерода до 6,67%, то есть до такого количества, при котором образуется цементит Fе3С. По диаграмме состояния системы железо - углерод судят о структуре медленно охлажденных сплавов, а также о возможности изменения их микроструктуры в результате термической обработки, определяющей эксплуатационные свойства.  , происходит при нагреве выше критической температуры А1, минимальной свободной энергией обладает аустенит.
, происходит при нагреве выше критической температуры А1, минимальной свободной энергией обладает аустенит. 2. Превращение аустенита в перлит
2. Превращение аустенита в перлит 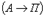 , происходит при охлаждении ниже А1, минимальной свободной энергией обладает перлит:
, происходит при охлаждении ниже А1, минимальной свободной энергией обладает перлит: 3. Превращение аустенита в мартенсит
3. Превращение аустенита в мартенсит 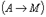 , происходит при быстром охлаждении ниже температуры нестабильного равновесия
, происходит при быстром охлаждении ниже температуры нестабильного равновесия 
 ; – происходит при любых температурах, т.к. свободная энергия мартенсита больше, чем свободная энергия перлита.
; – происходит при любых температурах, т.к. свободная энергия мартенсита больше, чем свободная энергия перлита.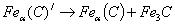 )
) - хорошие литейные свойства,
- хорошие литейные свойства,


