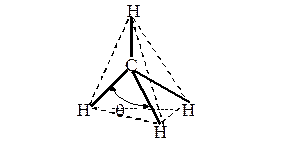Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Атомный уровень организации веществаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ТЕМА 1 АТОМНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ВЕЩЕСТВА
Все химические превращения в неживой и живой природе происходят на уровне атомов и молекул. Атом состоит из заряженных частей. Подобно солнечной системе, он имеет центральную часть и окружение. Практически вся масса атома сосредоточена в ядре. Непрерывно движущиеся электроны охватывают громадную по сравнению с ядром область пространства. Если представить ядро атома водорода с горошину, то область движения электрона будет охватывать сферу радиусом более 100 м. Атом - это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра. Атом – микросистема, потому что реальный размер любого атома имеет порядок 10-10 м.
Модели атомов Наши знания существуют в виде моделей. Модель есть объект-заменитель объекта-оригинала, сохраняющий некоторые его свойства. Существенными преимуществами модели перед оригиналом являются её доступность, обозримость, удобство в обращении. Первой моделью атома можно считать модель греческого натурфилософа Демокрита (ок. 460 – 370 г. до н. э.). В его представлении атом – предел делимости всего сущего [др.-греч. atomoV неделимый]. Атомы невидимы из-за своих ничтожных размеров, не разрушаются и не гибнут, а по естественной необходимости образуют отдельные тела и весь мир с его множеством свойств. Так силой ума, воображения была представлена умозрительная модель, которая просуществовала более двух тысячелетий и послужила хорошим основанием для поиска количественных характеристик неделимых микрочастиц. Именно свойство неделимого атома было положено в основу определения относительных атомных масс химических элементов. Такое представление об атомах просуществовало вплоть до конца ХIХ в. Первый шаг в раскрытии тайны строения атомов сделал английский физик Дж.Дж. Томсон (1856-1940), который в 1897 г. открыл электрон. Его масса оказалась в 1837 раз меньше массы атома водорода. Следовательно, атом делится на части, причем эти части заряжены. Электроны – отрицательно заряженные частицы. Положительно заряженная часть атома делает в целом атом электронейтральным. Дальнейшие исследования вещества привели нобелевского лауреата, английского физика Э. Резерфорда (1871-1937) к созданию планетарной (ядерной) модели атома. Экспериментальные доказательства такой модели у Э.Резерфорда были. Его молодой сотрудник Э. Марсден изучал движение потока положительно заряженных a-частиц сквозь тончайшую фольгу из золота и других металлов. Он обнаружил, что очень редко a-частицы отклонялись от прямолинейного движения сквозь фольгу, «отскакивали» от нее. Отскоки означали, что a-частицы «налетают» на массивные тела. Редкие отскоки означали, что массивные тела имеют ничтожно малые размеры и находятся на большом расстоянии друг от друга. Следовательно, атомы в металле устроены так, что их масса неравномерно распределена по всему объему атома. Положительно заряженные a-частицы могут отклоняться при своем движении только при сближении с положительно заряженной частью атома – ядром. Но как удерживаются на расстоянии и не падают на ядро в результате притяжения отрицательно заряженные электроны? Ответа на этот вопрос Э. Резерфорд не знал. Вот что он писал в статье, опубликованной в 1911 г.: «Вопрос об устойчивости предлагаемого атома на этой стадии не следует подвергать рассмотрению. Устойчивость окажется, очевидно, зависящей от тонких деталей структуры атома и движения составляющих его заряженных частей». По законам электростатики, чтобы сохранить устойчивость, электроны должны двигаться. По законам электродинамики, ускоренно двигаясь вокруг ядра, электроны должны излучать энергию и упасть на ядро. Получался замкнутый круг: движение электронов обеспечивает устойчивость, но оно же делает атом неустойчивым. Теоретическое обоснование устойчивости атома дал в 1913 г. датский физик-теоретик Нильс Бор (1885-1962). Сущность его идеи заключалась в следующем. Спектры излучения возбужденных атомов (они по внешнему виду напоминают штрих-код на товаре) натолкнули его на идею о дискретности энергетических состояний атомов [ лат. discretus разделенный, прерывистый ]. Электроны «заселяют» энергетические уровни подобно тому, как это делают жильцы, заселяя квартиры на этажах многоквартирного дома (заметим, что между этажами никто не живет). Законы, такого заселения еще не известны. Так рассуждал Бор. Если законы не известны – их следует искать. А пока можно сформулировать постулаты (утверждения, принимаемые за истинные, хотя и не доказанные), которые соответствуют тому факту, что атомы – устойчивые микросистемы. Постулаты Бора соответствовали квантовой модели водородоподобного атома и совершенно не согласовывались с представлениями классической физики: в атоме существуют стационарные, разрешенные орбиты, двигаясь по которым, электроны не излучают энергию и не падают на ядро; поглощение (или излучение) энергии атомом происходит только при переходе электрона с одной стационарной орбиты на другую. Двадцатисемилетний Нильс Бор говорил о движении электронов по орбитам в поле ядра без потери энергии. Чем дальше от ядра расположены электроны, тем больше должна быть энергия движения электрона, противодействующая притяжению ядра. На вопрос, почему такие свойства проявляют движущиеся противоположно заряженные заряды, тогда можно было дать только один ответ: «так устроен мир микрочастиц». В настоящее время доказано, что в атоме не существует траекторий, но есть область, где чаще или реже можно обнаружить движущиеся электроны. Это не орбита, а орбиталь – отрицательно заряженная область атома, в которой вероятность обнаружить движущийся электрон (или электроны) уменьшается по мере удаления от ядра. На рис. 2 представлены модели атомов водорода и гелия, а стрелками обозначено количество электронов на орбитали. Точками обозначено «электронное облако». Электронное облако - это не наглядный образ самого электрона или электронов, «размытых» в пространстве, а наглядное изображение области возможного местонахождения электронов по отношению к ядру. Пунктиром отмечена сферическая область - орбиталь, где сосредоточена подавляющая часть электронной плотности. Центральная точка – атомное ядро, стрелками обозначены спины электронов. Электронное облако характеризует состояние движения электрона. Такое состояние движения напоминает движение футбольного вратаря. Чаще всего он находится в штрафной площадке, и чем дальше от ворот, тем меньше вероятность встретить его там. Но если движение вратаря во время матча все-таки можно изобразить некоторой траекторией, то для электрона такой возможности не существует в принципе.
   
Рис. 2. Модели атомов водорода и гелия
Уже будучи нобелевским лауреатом, Н. Бор часто с улыбкой вспоминал, как в 1950-х гг. к нему подошел после лекции студент и спросил: «Неужели действительно были такие идиоты, которые думали, что электрон вращается по орбите?». В многоэлектронных атомах, кроме сферической s- орбитали, существуют p- орбитали (рис. 3), а также d- и f -орбитали, отличающиеся по форме и пространственному расположению.
Рис. 3. Модель атома кислорода. Указаны 2 р х, 2 р у и 2 р z-орбитали и спины электронов. Пунктиром обозначены 1 s - и 2 s -орбитали, но электронные пары на них не изображены
Итак, атом - это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра. Любое определение, включая и приведенное выше, отражает лишь ограниченное число свойств оригинала. Например, следует принять во внимание структуру ядра атома. Ядро атома – это тоже микросистема, которая состоит из протонов и нейтронов. Число протонов определяет заряд ядра (Zя), а число нейтронов (N) в сумме с числом протонов выражают массовое число атома (А): А = Zя + N
Взаимодействия в атомах Энергия притяжения электронов к ядру, а также энергия движения электронов, стремящаяся оторвать электрон от атома, уравновешены, и атом сохраняет устойчивое состояние. Только воздействие внешней среды способно вывести атом из этого состояния. В роли внешней среды выступают микрочастицы вещества (атомы, молекулы, электроны) и поля (фотоны). Рассмотрим атом водорода. По законам классической механики и электродинамики атом водорода – неустойчивая система. По законам квантовой механики, это устойчивая система, и сближение электрона с ядром не должно привести к его «падению» на ядро. В 1927 г. В. Гейзенберг сформулировал действующий в квантовой механике принцип неопределенности: объект микромира невозможно одновременно с наперед заданной точностью характеризовать координатой и импульсом. Если неопределенность в определении координаты х составляет D х, а неопределенность в определении импульса mu составляет D(mu), то неопределенности этих величин удовлетворяют условию (1.1)
где m – масса; u – скорость микрочастицы, движущейся вдоль координаты х; h – постоянная Планка.
Уравнение (1.1) получило название соотношения неопределенности Гейзенберга. Потенциальная энергия (Е) атома водорода складывается из кинетической энергии электрона (U): U = и энергии притяжения электрона ядром (V). Заряды ядра (в данном случае протона) и электрона равны по величине и противоположны по знаку (заряд е):
Е = U + V = где u - скорость движения электрона массой m; r – радиус орбитали. Состояние электрона с точно установленными значениями координаты r и импульса mu означало бы нарушение соотношения неопределенности Гейзенберга. Допустим, что неопределенность в определении координаты имеет порядок самой координаты (D r» r), а неопределенность в определении импульса имеет порядок самого импульса (D mu» mu). Согласно соотношению неопределенности получим: r × mu = Подставляя значение u из уравнения (1.3) в выражение потенциальной энергии (1.2), получим: Е = Устойчивому состоянию атома соответствует минимум потенциальной энергии
Отсюда Полученное значение r min совпадает с радиусом первой боровской орбиты атома водорода. Подставив r min из уравнения (1.5) в уравнение (1.4), найдем энергию основного состояния атома водорода:
Эта величина соответствует минимальной энергии атома водорода (рис. 4).
Свойства атомов Свойство – это качество, постоянно присущее объекту. Это качество проявляется не само по себе, а в отношении данного объекта с другим. Например, для того, чтобы атом проявлял свойство отдавать электроны, необходим партнер, способный принимать электроны. Такая картина повторяется при описании любых свойств. Поэтому свойство иногда называют «свернутым отношением», подразумевая, что результат отношения объектов приписываем одному из них в качестве свойства, «забывая» о другом объекте. Атомы проявляют свойство обмениваться энергией с окружающей средой. Рассмотрим изменения энергетического состояния атома водорода при взаимодействии с электромагнитным излучением. Стационарное состояние атома соответствует положению электрона на низшем энергетическом уровне Е 1. Переход электрона на более высокий энергетический уровень Е 2 означает поглощение фотона (кванта электромагнитного излучения
Рис. 5. Спектральная серия Бальмера в спектре атома водорода
А томы проявляют свойство отдавать и присоединять электроны. Энергия, которую необходимо затратить, чтобы оторвать электрон от атома, называется энергией ионизации (Еи, кДж/моль), например: Еи Li ® Li+ + е- Сродство атомов к электрону (Есэ, кДж/моль) характеризуется энергией, необходимой для отрыва электрона от соответствующего отрицательного иона (аниона), например: Е сэ Cl- ® Cl + е- Способность атомов участвовать в образовании химических связей включает в себя реакции образования и разрыва между атомами ковалентных, ионных или металлических связей: H + H ® H2 (H-H ковалентная связь) Li + F ® LiF (Li+F- ионная связь) Cu2+ + 2e- ⇄ Cu0 (Cu0 отражает образование металлической связи)
Краткий итог темы 1. Крайне важно знать, что атом представляет собой систему зарядов, противоположных по знаку (ядро и электроны). 2. Атом - чрезвычайно устойчивая динамическая система. 3. Электронное облако характеризует не образ «размытых» в пространстве электронов или электрона, а область вероятного местонахождения электронов относительно ядра. 4. Форма, пространственное расположение орбиталей и последовательность заполнения электронами энергетических уровней определяется квантовыми числами и квантовыми правилами. 5. Носителем свойств атомов является атомное ядро. Заряд ядра определяет количество электронов в электронейтральном атоме и, следовательно, характер распределения электронов по энергетическим уровням. Отсюда вытекают такие свойства атомов, как энергия ионизации, сродство к электрону, валентность, способность образовывать различные типы химических связей и их количество.
Термины для запоминания Следует ориентироваться в физических и химических терминах и понятиях. Запоминание (знание) всегда должно следовать за пониманием. Если понятен смысл терминов и определений, их легче запомнить и применить в смежных областях знаний. Проверьте свои знания. Лучший способ сделать это – записать определение термина или понятия своими словами, не заглядывая в текст. Термины и понятия не нужно заучивать наизусть, но передать их смысл близко к тексту необходимо. Если вы затрудняетесь в написании определения терминов и понятий – прочитайте соответствующий раздел темы еще раз. Атом- это микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в поле ядра. Главное квантовое число (n) – параметр, с помощью которого можно вычислить энергию электрона в атоме. Группа – вертикальный ряд периодической системы, в котором объединены атомы химических элементов с одинаковым числом электронов на внешней орбитали. Квантовые числа определяют значения физических величин, характеризующих атом, ядро атома, молекулу или элементарные частицы. Магнитное квантовое число (ml) определяет число орбиталей для данного значения орбитального квантового числа l. Модель есть объект-заменитель объекта-оригинала, сохраняющий некоторые его свойства. Орбиталь – отрицательно заряженная область атома, в которой вероятность обнаружить движущийся электрон (или электроны) уменьшается по мере удаления от ядра. Орбитальное квантовое число (l) – параметр, с помощью которого можно определить форму орбитали и энергию подуровня. Период – это горизонтальный ряд элементов, в атомах которых электроны последовательно заполняют ns- и завершают заполнение np-орбиталей. Периодический закон: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов. Правило Гунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором сумма спиновых чисел максимальна (å ms = max ). Принцип запрета Паули: на одной орбитали не может быть больше двух электронов, различающихся спиновыми числами ms = +1/2 и -1/2. Принцип наименьшей энергии: электроны заполняют орбитали в порядке возрастания энергии от низшего к высшему энергетическому уровню. Принцип неопределенности: объект микромира невозможно одновременно с наперед заданной точностью характеризовать координатой и импульсом. Свойство – это качество, постоянно присущее объекту. Система есть совокупность взаимосвязанных частей, выделенных из окружающей среды и выступающих по отношению к ней как целое. Соотношение неопределенности: Спин электрона – собственный момент количества движения электрона. В моделях атомов спин обозначается . Химия – наука, изучающая состав, свойства и превращения вещества, а также явления, которые сопровождают эти превращения. Электронное облако характеризует не образ «размытых» в пространстве электронов или электрона, а область вероятного местонахождения электронов относительно ядра. Ядро атома – микросистема, которая состоит из протонов и нейтронов.
Вопросы для проверки знаний 1. Объясните, почему модель Демокрита считают умозрительной? 2. Что подразумевается под моделью атома Э. Резерфорда? 3. В чем сильные и слабые стороны постулатов Н. Бора? 4. Каким образом заряд ядра атома влияет на свойства атома? 5. Что подразумевается под понятием «электронная орбиталь»? 6. Что такое атом? 7. В чем смысл квантовых чисел? 8. Согласны ли вы с утверждением, что «электронным клеем», соединяющим атомы, являются электрические силы притяжения? 9. Согласны ли вы с утверждением, что по мере увеличения заряда ядра атомные орбитали сокращаются в размере? 10. По какому признаку атомы элементов объединены в периоды, в группы? 11. В чем физический смысл номера периода, номера группы, порядкового номера элемента? 12. Согласны ли вы с утверждением, что даже современная формулировка периодического закона имеет недостатки?
Упражнения 1. Сколько электронов входит в состав атомов с зарядом ядра: а) +2, б) +6, в) +9? 2. Сколько протонов в ядре атома, если число электронов: а) 4; б) 10; в) 30? 3. Какова форма орбиталей в атомах с зарядом ядра +1 и +2? 4. Какой из атомов проявляет большую склонность отрывать электроны от соседних атомов: кислород или фтор? Ответ обоснуйте. 5. Ядро атома содержит 6 протонов и 7 нейтронов. Сколько электронов содержит электронейтральный атом? Напишите его химический символ с указанием массового числа и заряда ядра. 6. Сколько электронов в электронейтральном атоме, если заряд ядра равен: а) +3, б) +7, в) +10? 7. Как называется частица, заряд ядра которой равен +3, а электронная оболочка представлена двумя электронами? 8. Обоснуйте существование трех p -орбиталей на каждом энергетическом уровне, начиная со второго. 9. Какой заряд ядра имеет химический элемент, у которого: а) завершено заполнение электронами 2 p -орбиталей; б) заполнена одним электроном 3 p -орбиталь. 10. Сколько элементов в 1, 2 и 3 периодах? Объясните число элементов в периоде, пользуясь значениями квантовых чисел и правилами заполнения орбиталей. 11. Структура внешних орбиталей атомов выражается электронными формулами: а) 2 s 2; б) 5s25p4; в) 3s23p5; г) 4s1. Определите порядковые номера и названия элементов. 12. Определите: а) число энергетических уровней; б) число внешних электронов у атомов с зарядом ядра: 1) +35, 2) +17, 3) +20, 4) +15.
ТЕМА 2 Связь Рассмотрим молекулярные структуры с присущими им ковалентными связями. Ковалентная связь обусловлена электромагнитным взаимодействием, удерживающим положительно заряженные ядра отрицательным зарядом, сосредоточенным в области перекрывания атомных орбиталей. В атомах число атомных орбиталей, принимающих участие в образовании ковалентных связей, ограничено, следовательно для образования ковалентных связей характерна насыщаемость. Так, в молекуле Н2 (Н-Н) одна ковалентная связь между атомами водорода, и невозможно молекулярное образование Н4 в силу того обстоятельства, что пара электронов, участвующая в образовании ковалентной связи, заняла две s -орбитали, а в соответствии с принципом запрета Паули больше двух электронов с противоположными спинами на перекрывающихся орбиталях быть не может. В атоме кислорода во внешней электронной оболочке две орбитали содержат по одному неспаренному электрону. Они принимают участие в образовании двух расположенных под некоторым углом друг к другу ковалентных связей в молекуле воды. Следовательно, ковалентные связи характеризуются не только насыщаемостью, но и направленностью. Молекула – микросистема, состоящая из двух или большего числа ядер и электронов, движущихся в поле ядер, и содержащая ковалентные связи. На рис. 8 представлены структурные модели молекул.
формулы формулы
  
  
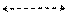   
Рис. 8. Модели молекул H2 и F2 с неполярными ковалентными связями и HF и Н2S с полярными ковалентными связями. В атомах фтора и серы изображены соответственно только внешние 2 р и 3 р -орбитали Область перекрывания атомных орбиталей несет отрицательный заряд (δ-), удерживающий положительно заряженные ядра на расстоянии, соответствующем длине химической связи (lсв). Длина ковалентной связи – это расстояние между ядрами ковалентно связанных атомов молекулы. Пара электронов ⇅, участвующая в образовании ковалентной связи (валентные электроны от лат. valentiа – сила), принадлежит обоим атомам. В молекулах водорода Н2 и фтора F2 распределение электронной плотности симметрично относительно ядер. Зона перекрывания атомных орбиталей расположена между ядрами атомов. В них электронная пара в равной степени принадлежит обоим атомам. Такую ковалентную связь называют неполярной. Центры тяжести положительных и отрицательных зарядов таких молекул совпадают. Это молекулы недиполи. В молекулах фтороводорода HF и сероводорода H2S зоны перекрывания атомных орбиталей несимметрично расположены между ядрами атомов. Электронная плотность в большей степени смещена к ядру атома фтора в HF и к ядру атома серы в H2S. Такие ковалентные связи называют полярными.
Гибридизация, s- и p-связи На рис. 9 представлена молекула метана СН4 с ковалентными s-связями. Ковалентная s-связь образуется между атомами при перекрывании орбиталей вдоль линии, проходящей через ядра атомов. Рассмотрим структуру пятиатомной молекулы метана СН4. Четыре ковалентных связи (темные линии) расположены в пространстве симметрично (рис. 9). Если атом углерода поместить в центре тетраэдра, то химические связи, соединяющие атом углерода с атомами водорода, направленны к его вершинам. Как могли образоваться четыре равноценные связи в метане при наличии в атоме углерода двух электронов, расположенных на 2 р -орбиталях, напоминающих по форме спортивные гантели, и двух электронов на сферической 2 s -орбитали? Это возможно, если атом углерода переходит из основного 1s22 s 22 p 2 в возбужденное состояние 1s22 s 12 p 3, перестраивая внешние электронные оболочки (рис. 10). На рис. 11 показано sp3 гибридное состояние атома углерода в молекуле метана.
Рис. 9. Модель молекулы метана. Угол q между С—Н связями составляет 109.280
Рис. 10. Распределение электронов по энергетическим уровням (квантовым ячейкам) в атоме углерода: основное состояние С и возбужденное состояние С*
Гибридизация представляет собой способ описания перестройки атомных орбиталей в молекуле по сравнению со свободным атомом. Эта идея принадлежит выдающимся физикам Л. Полингу и Д. Слэтеру.
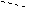      

Рис. 11. Состояние атома углерода(sp3 гибридизация) в молекуле метана
Гибридизация позволяет объяснить существование не только одинарных, но двойных и тройных связей между атомами. В молекуле метана (рис. 11 и 12 а) sp3 -гибридизация атома углерода обеспечивает расположение ковалентных s-связей под углом 109.280. В молекуле этилена атом углерода существует в sp2 гибридном состоянии. Три sp2 -гибридные орбитали углерода расположены в одной плоскости под углом 1200 и одна р -орбиталь перпендикулярна плоскости. В молекуле этилена Н2С=СН2 между атомами углерода образуется двойная связь: одна – s (сигма) -связь, вторая – p (пи) -связь (рис. 12, б). p -Связь между атомами осуществляется таким образом, что образуются две области перекрывания р-орбиталей по обе стороны от оси s-связи. В молекуле ацетилена НС≡СН, имеющей тройную химическую связь, атомы углерода находятся в состоянии sр -гибридизации. В атомах углерода ацетилена существуют две взаимно перпендикулярные р -орбитали и две sp- гибридных орбитали, находящиеся под углом 1800 (рис. 12, в). а) б) в)
Рис. 12. Положение s- и p-связей в молекулах метана, этилена и ацетилена; s-связи представлены линиями, p-связи – перекрыванием р -орбиталей
Донорно-акцепторная связь Взаимодействия молекул с образованием донорно-акцепторной ковалентной связи широко распространены. Такие связи еще называются координационными. Донор электронов располагает атомом, одна из орбиталей которого содержит пару электронов. Акцептор электронов располагает атомом, одна из орбиталей которого вакантна, т.е. не заселена электронами. Когда взаимодействуют молекулы электроноакцепторы и электронодоноры, перекрывание орбиталей приводит к образованию донорно-акцепторной ковалентной связи. Донорно-акцепторная ковалентная связь образуется между атомами при участии пары электронов электронодонора и вакантной орбитали электроноакцептора. На рис. 13 представлено образование донорно-акцепторной связи при взаимодействии газообразного аммиака и хлороводорода. Атом водорода с вакантной орбиталью соединяется с молекулой аммиака донорно-акцепторной связью, оставляя при этом свой электрон атому хлора.
Рис. 13. Механизм образования донорно-акцепторной связи
Азот в аммиаке выполняет функцию донора, а ион водорода – акцептора электронов. Переход водорода от хлороводорода без электрона компенсируется парой электронов атома азота. В образовавшемся ионе NH4+ все связи ковалентные и равноценные.
2.4. Ионная связь Случаю предельной поляризации ковалентной связи отвечает ионная связь. Ионная связь отличается от ковалентной тем, что при её образовании практически отсутствует перекрывание атомных орбиталей. Например, при сближении иона лития Li+ с ионом фтора F– происходит их объединение в ионную пару за счет электростатического притяжения (рис. 14). Ионная связь обусловлена взаимодействием противоположно заряженных сферических ионов, удерживающая их на расстоянии длины химической связи.
  
Рис. 14. Ионная связь во фториде лития Li+F-. Пунктиром обозначена 2 s -орбиталь, электрон с которой перешел на 2 р - орбиталь атома фтора; 2 s -орбиталь фтора не обозначена
Длина ионной связи соответствует расстоянию между центрами ионов. Ионная связь образуется между атомами, существенно отличающимися по электроотрицательности. Электроотрицательность атома – параметр, характеризующий способность атома притягивать к себе электрон. Расчеты электроотрицательности (ЭО) были выполнены Л. Полингом и Р. Малликеном. Большинство химиков пользуется шкалой электроотрицательности Полинга (табл. 2). Чем выше разность электроотрицательностей химически связанных атомов, тем полярнее связь, достигающая в пределе состояния ионной пары. Существует качественная оценка ионности связи (i): Таблица 2 Связей Для характеристики трех типов химических связей – ковалентной, ионной и металлической используются методы валентных связей (ВС) и молекулярных орбиталей (МО). На заре использования квантовой механики в химии (В. Гейтлер и Ф. Лондон, 1927 г.) было доказано, что волновое уравнение (его называют уравнением Шредингера) справедливо для описания как свойств атомов, так и молекул. В молекулах, ионных соединениях и металлах действуют электрические силы притяжения и отталкивания, которые взаимно уравновешены и обеспечивают их устойчивость. Теоретические расчеты квантовой механики позволили сформулировать следующие положения метода валентных связей:
В методе, предложенном Гейтлером и Лондоном, образование химической связи рассматривается как результат перекрывания атомных орбиталей (АО), заселенных электронами с противоположными спинами. Но это не единственный подход к объяснению химической связи. Существует метод молекулярных орбиталей (МО). Он основан на допущении, что электроны, участвующие в образовании химической связи, образуют молекулярные орбитали, как в атоме атомные орбитали. Принцип запрета Паули, правило Гунда, принцип наименьшей энергии (правило Клечковского) справедливы и для молекулярных орбиталей. Основы метода МО разработаны Р. Малликеном и Ф. Гундом в 1928-1930 гг. и сводятся к следующим положениям: 1. молекула - это единая система ядер и электронов, а не совокупность атомов, сохраняющих некоторую индивидуальность; 2. электроны в молекулах располагаются на молекулярных орбиталях (МО); 3. число образовавшихся связывающих и разрыхляющих МО равно числу АО исходных атомов; 4. устойчивость молекулы определяется разностью числа электронов на связывающих и разрыхляющих орбиталях. Эта разность выражает порядок связи. Для описания электронного состояния молекулы в методе МО используются энергетические диаграммы, аналогичные диаграммам энергетических уровней в атомах. Если в поле ядер двухатомной молекулы, например молекулы водорода, электроны движутся так, что «мешают» друг другу (отталкиваются), образуется разрыхляющая молекулярная орбиталь. Разрыхляющая орбиталь препятствует образованию хими
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1070; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.251.103 (0.011 с.) |






 , (1.1)
, (1.1)

 , (1.2)
, (1.2) (1.3)
(1.3)
 . Продифференцировав выражение (1.4) по r и приравняв
. Продифференцировав выражение (1.4) по r и приравняв  , получим:
, получим: -
-  +
+  = 0.
= 0. (1.5)
(1.5)




 ) и переход атома в возбужденное состояние. В возбужденном состоянии атом пребывает крайне короткое время (~ 10-8 с). В соответствии с законом сохранения энергии возбужденный атом излучает квант поглощенной энергии и возвращается в устойчивое состояние. Квантовые переходы фиксируются приборами в виде линейчатых спектров атома водорода. Один из них представлен на рис. 5.
) и переход атома в возбужденное состояние. В возбужденном состоянии атом пребывает крайне короткое время (~ 10-8 с). В соответствии с законом сохранения энергии возбужденный атом излучает квант поглощенной энергии и возвращается в устойчивое состояние. Квантовые переходы фиксируются приборами в виде линейчатых спектров атома водорода. Один из них представлен на рис. 5.

 Структурные Молекулярные
Структурные Молекулярные