
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Атом, молекула. Элемент, простое вещество,Содержание книги
Поиск на нашем сайте
Вводный курс Основные понятия
Атом, молекула. Элемент, простое вещество, Соединение Основная идея химии – все вещества состоят из атомов. Атом – простейшая частица вещества, неделимая химическими методами *.Атом состоит из ядра и электронов. Основная химическая характеристика атома – заряд его ядра. Атомы, имеющие одинаковый заряд ядра, называют химическим элементом. Атом сохраняет все химические свойства элемента.Известные к настоящему времени химические элементы сведены в периодическую систему элементов (сокращенно - ПСЭМ) Д.И.Менделеева. Каждый элемент обозначается латинским символом и имеет русское и латинское название. В таблице 1.1. приведены русские названия, символы и произношение символов при чтении химических формул ряда наиболее часто встречающихся элементов. Таблица 1.1. Названия некоторых элементов, их символы и произношение символов в формулах
*Жирным курсивом выделен материал, обязательный для запоминания.
Атомы могут соединяться между собой, образуя молекулы. Молекула – наименьшая частица вещества, обладающая его химическими свойствами. Вещества делятся на простые и сложные или соединения. Простые вещества состоят из атомов одного элемента, а соединения – из атомов различных элементов. Элемент может образовывать несколько простых веществ, например: элемент кислород образует простые вещества – кислород, состоящий из молекул О2 (читается - о два) и озон, состоящий из молекул О3 (читается – о три). Соединение содержит как минимум атомы двух разных элементов, например: углекислый газ или оксид углерода (IV) состоит из молекул СО2, (читается – цэ о два), образованных одним атомом углерода и двумя атомами кислорода.
Моль. Молярная масса. Закон Авогадро. В качестве единицы количества вещества в химии используют моль. Моль – количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов и др.) сколько содержится атомов в 0,012кг изотопа углерода 12С. Это число точно определено, составляет 6,02.1023 и носит название постоянная Авогадро. Обозначается количество вещества символом nB; например nCaO= 2 моль, т.е. количество вещества оксида кальция равно 2 моль, т.е. содержит 2. 6,02.1023=12,04.1023 формульных единиц СаО. Массу одного моль вещества В называют молярной массой; обозначение МВ. Единицами измерения молярной массы являются г/моль и кг/моль. Помимо молярной массы вещество может быть охарактеризовано относительной молярной массой, равной массе молекулы или иной структурной единицы вещества, отнесенной к 1/12 массы одного атома изотопа углерода 12С; обозначение Mr(B). Относительная молярная масса является величиной безразмерной. Относительные молярные массы элементов, называемые обычно относительными атомными массами (Аr(B)), приведены в ПСЭМ. Относительные атомные массы наиболее употребительных элементов необходимо запомнить (Таблица 1.2.). Молярная масса вещества В (символ MB, единица _ кг/моль) _ это масса вещества В (mB), деленная на количество вещества nB, или это масса 1 моль вещества (6,02.1023 формульных единиц вещества (атомов, молекул, ионов, электронов и т.д.)). Молярная масса вещества (МВ) численно равна относительной молярной массе, например: относительная молярная масса натрия Mr(Na)=22,98977, а молярная масса натрия равна МNa=22,98977 г/моль. Относительные атомные массы элементов используют для вычисления молярных масс соединений.
Таблица 1.2. Округленные значения относительных атомных масс некоторых элементов.
Пример 1.1. Найти молярную массу серной кислоты H2SO4. Решение. Молярная масса серной кислоты численно равна сумме двух относительных атомных масс водорода, одной относительной атомной массы серы и четырех относительных атомных масс кислорода и измеряется в г/моль:
Химические формулы Химические формулы выражают количественный и качественный состав соединения и, одновременно, обозначают массу, соответствующую 1 моль вещества. Например, формула азотной кислоты HNO3 означает: 1) это вещество образовано 1 атомом водорода, 1 атомом азота и 3 атомами кислорода или одним ионом водорода (Н+) и одним нитрат-ионом ( Пример 1.5. Найти процентное содержание кальция, водорода и кислорода в гидроксиде кальция Са(OН)2. Решение. Найдем молярную массу гидроксида кальция. Для этого в таблице ПСЭМ найдем относительные атомные массы кальция, кислорода и водорода и подставим их в формулу:
Для нахождения процентного содержания кальция составим пропорцию: 74г Са(OН)2 содержат 40г кальция 100г - “ - - “ - х - “ – Следовательно, процентное содержание кальция в Са(OН)2 составит:
Аналогично находим процентное содержание водорода и кислорода: 74г Са(OН)2 содержат 2г водорода 100г - “ - - “ - х г - “ –
74г Са(OН)2 содержат 32г кислорода 100г - “ - - “ - х г - “ –
Проверим правильность вычислений. Суммарное содержание всех трех элементов в гидроксиде кальция составляет: 54,05+2,70+43,24=99,99 % Отклонение полученной величины от 100 % на 0,01% связано с округлением результатов. Пример 1.6. Найти массу одной формульной единицы (молекулы) хлорида натрия (поваренной соли). Решение. 1 моль NaCl содержит 6,02.1023 формульных единиц (молекул). Молярная масса хлорида натрия составляет
Составим пропорцию: Масса 6,02.1023 молекул NaCl составляет 58,5г Масса 1 - “ - - “ - - “ - - “ - х г
Пример 1.7. Найти простейшую формулу соединения, содержащего (по массе) 40 % углерода, 6,7 % водорода, 53,3 % кислорода, если плотность его паров по водороду составляет 15. Решение. Обозначим числа атомов углерода, водорода и кислорода в простейшей формуле соединения через x, y и z. Молекулярные массы этих элементов равны 12, 1 и 16. Поэтому массы углерода, водорода и кислорода в составе соединения относятся как 12x:1y:16z. По условиям задачи это отношение равно 40:6,7:53,3. Следовательно, 12x:y:16z=40:6,7:53,3, откуда Чтобы выразить полученное отношение целыми числами, разделим его члены на меньший из них:
Таким образом, простейшая формула соединения - СН2О. Молекулярная масса соединения Мr=12+2+16=30. Молекулярная масса, определенная по относительной плотности, составляет М = 2.15=30. Следовательно, простейшая и истинная формулы соединения совпадают. Химические уравнения
Химические уравнения показывают вещества, вступающие в химическую реакцию и образующиеся в результате продукты, а также количественные отношения между всеми участниками реакции. Например, уравнение 2HCl + Ca(OH)2 = CaCl2 + 2H2O означает, что в реакцию вступают 2 моль соляной кислоты и 1 моль гидроксида кальция; образуется 1 моль хлорида кальция и 2 моль воды, а массы исходных веществ и продуктов реакции удовлетворяют соотношению:
Пример 1.8. Серная кислота (H2SO4) реагирует с гидроксидом калия по уравнению H2SO4 + 2KOH = K2SO4 + 2H2O Найти массу гидроксида калия, необходимую для реакции с 20г серной кислоты и массы сульфата калия и воды, образующиеся в результате реакции. Решение. Молярные массы участников реакции составляют, соответственно: 98 (H2SO4); 56 (KOH); 176 (K2SO4) и 8 (H2O) г/моль. Из уравнения реакции следует, что 1 моль серной кислоты реагирует с 2 моль гидроксида калия или 98г H2SO4 взаимодействуют с 2.56=112г KOH. Составим пропорцию: 98г H2SO4 реагируют со 112г КОН 20г - “ - - “ - х г - “ -
Аналогично в соответствии с уравнением реакции запишем: Из 98г H2SO4 образуется 176г K2SO4 Из 20г - “ - - “ - х г - “ -
Из 98г H2SO4 образуется 36г Н2O Из 20г - “ - - “ - х г - “ –
Пример 1.9. При взаимодействии серной кислоты и карбоната натрия выделилось 5,0л углекислого газа (н.у.). Найти массы серной кислоты и карбоната натрия, взятые для реакции, а также массу сульфата натрия, образовавшуюся в результате реакции. Решение. Запишем уравнение реакции: H2SO4 + Na2CO3 = Na2SO4 + CO2 + H2O Из уравнения реакции следует, что в реакцию вступают 1 моль серной кислоты и 1 моль карбоната натрия и образуется по 1 моль сульфата натрия, углекислого газа и воды. Иначе говоря, в реакцию вступают 98г H2SO4 и106 г Na2CO3, а образуется 142г Na2SO4, 44г CO2 и 18г H2O. Один моль углекислого газа, или 44г, занимают при нормальных условиях объем 22, 4 дм3(л). Молярные массы участников реакции составят: Для получения 22,4л CO2 необходимо взять 98г H2SO4 - “ - - “ - 5л - “ - - “ - х г - “ -
Количество углекислого газа можно выразить в граммах: масса 22,4 л CO2 составляет 44 г - “ - 5 л - “ - - “ - х г
и при последующих вычислениях использовать массу газа, а не объём. Основываясь на уравнении реакции, найдём массы Na2CO3, Na2SO4 и H2O: Для получения 44г CO2 необходимо взять 106г Na2CO3 - “ - - “ - 9,82г - “ - - “ - х г - “ –
при получении 44г CO2 образуется 142г Na2SO4 - “ - - “ - 9,82г - “ - - “ - х г - “ –
при получении 44г CO2 образуется 18г H2O - “ - - “ - 9,82г - “ - - “ - х г - “ –
Контрольные вопросы и задачи 1.1.Найти количество вещества азотной кислоты, если её масса составляет 100г. Ответ: 1,59 моль. 1.2. Найти количество вещества азота, если его объем при нормальных условиях составляет 15 дм3. Ответ: 0,67 моль. 1.3. Найти число формульных единиц гидрокарбоната кальция, число атомов кальция, водорода, углерода и кислорода, содержащихся в 300г Ca(HCO3)2. Ответ: 1.4. Найти процентное содержание магния, азота и кислорода в нитрате магния Mg(NO3)2. Ответ: ωMg=16,2; ωN=18,9; ωMg=64,9%. 1.5.Найти массу одной молекулы хлора. Ответ:1,18.10-22г. 1.6. Найти массу гидроксида кальция, необходимую для реакции с 10г соляной кислоты и массы хлорида кальция и воды, образующиеся в результате реакции 2HCl + Ca(OH)2 = CaCl2 + 2H2O. Ответ: 1.7. Найти массу оксида кальция, воды и объем углекислого газа, образующихся при термическом разложении 200г гидрокарбоната кальция по реакции: Сa(HCO3)2=CaO+H2O+2 CO2. Ответ:
Строение атома
Атом состоит из ядра и электронной оболочки. Ядро состоит из заряженных протонов и незаряженных нейтронов. Число протонов равно порядковому номеру элемента в ПСЭМ. Например, порядковый номер кальция в ПСЭМ равен 20, следовательно, ядро кальция содержит 20 протонов. Число нейтронов определяется как разность между атомной массой изотопа элемента и его порядковым номером. Например, порядковый номер углерода в ПСЭМ равен 6, следовательно, ядро изотопа углерода 12С содержит 12 – 6 = 6 нейтронов, а изотоп углерода 14С содержит 14 – 6 = 8 нейтронов. Атомные массы элементов, приведенные в ПСЭМ, представляют собой средние атомные массы природной смеси различных изотопов элементов, поэтому эти величины не всегда могут быть использованы для нахождения числа нейтронов в ядре атома. Заряд протона принято считать положительным. Заряд протона численно равен заряду электрона, который принято считать отрицательным. Атомы элементов электронейтральны, следовательно, число электронов в атоме равно числу протонов в ядре и равно порядковому номеру элемента в ПСЭМ. Электроны в атоме образуют электронные уровни и подуровни. Число электронных уровней атома равно номеру периода в ПСЭМ, в котором располагается элемент. Например, элемент калий находится в четвертом периоде, следовательно, его электроны располагаются на 4 электронных уровнях. Электронные уровни могут быть обозначены целыми положительными числами от 1 до 7, что соответствует числу периодов в ПСЭМ. Эти числа носят название главного квантового числа, которое обозначается буквой n. В пределах электронного уровня электроны располагаются на электронных подуровнях. Максимально возможное число электронных подуровней на данном электронном уровне равно номеру уровня. Например, на 3-м электронном уровне может быть 3 электронных подуровня, однако в действительности, число электронных уровней не превышает четырёх. Так, на 5-м и 6-м уровнях имеется только по 4 подуровня. Электронные подуровни обозначаются буквами латинского алфавита s, p, d, f и носят название орбитального или побочного квантового числа. На 1-м электронном уровне имеется только один электронный подуровень – s. Это записывается как 1s. На втором электронном уровне находятся 2 электронных подуровня s и p. Эти подуровни обозначаются как 2s и 2p. Соответственно, на 3-м электронном уровне электроны располагаются на трёх подуровнях 3s, 3p и 3d, а на 4-м – на четырёх подуровнях – 4s, 4p, 4d и 4f. Максимальное количество электронов на s-подуровне составляет 2, на p-подуровне -6, на d-подуровне – 10, а на f-подуровне -14. Количество электронов, находящихся на электронном подуровне обозначается правым верхним индексом. Например, если на р-подуровне 2-го электронного уровня находится 3 электрона, то это записывается как 2p3, а 7 электронов на d-подуровне 3-го электронного уровня обозначаются как 3d7. Если на электронном уровне находится несколько подуровней, то электроны в первую очередь заполняют s-подуровень, затем – p-подуровень, далее – d-подуровень и в последнюю очередь f-подуровень. Распределение электронов по энергетическим уровням и подуровням называется электронной формулой элемента. Пример 2.1. Записать электронную формулу атома элемента хлор. Решение. Порядковый номер хлора в ПСЭМ равен 17, следовательно, ядро атома хлора содержит 17 протонов и нейтральный атом имеет 17 электронов. Хлор находится в 3-м периоде ПСЭМ, следовательно, электроны расположены на трех электронных уровнях. На 1-м уровне имеется только один электронный подуровень s, на котором может находиться максимально 2 электрона (1s2). На 2-м уровне имеется 2 подуровня – s- и p, на которых могут располагаться максимально 2 и 6 электронов, соответственно (2s2 и 2p6). На 3-м уровне может быть 3 подуровня s-, p- и d. Но на этом уровне у атома хлора находится только 17-(2+2+6)=7 электронов. Два из них находятся на s- подуровне Таблица 2.1. Периодическая система элементов Д.И.Менделеева
* Л А Н Т А Н И Д Ы
.
(3s2) и 5 – на p-подуровне (3p5). Таким образом, электронная формула хлора будет иметь вид: 1s22s22p63s23p5. Электронные формулы первых 20 элементов ПСЭМ приведены в таблице 2.2.
Таблица 2.2. Электронные формулы элементов ПСЭМ.
Отметим, что изложенное применимо в полной мере только к элементам первых трёх периодов ПСЭМ. Периодическая система
Периодический закон Д.И.Менделеева формулируется так: Металлы. Неметаллы. Все элементы ПСЭМ делятся на металлы и неметаллы. К металлам относятся элементы главных подгрупп, расположенные в ПСЭМ ниже диагонали бор ( B), кремний (Si), мышьяк (As), теллур (Te), астат (At), все элементы побочных подгрупп, включая лантаниды и актиниды. Элементы, находящиеся в ПСЭМ выше этой диагонали, включая B, Si, Te, At, являются неметаллами. Элементы германий, мышьяк и сурьма относятся к т.н. полуметаллам. Эти элементы обладают свойствами, как металлов, так и неметаллов. Все металлы, за исключением ртути, при стандартных условиях (298К, 101,325 кПа) являются твердыми, блестящими веществами, хорошо проводят электрический ток. Неметаллы могут быть газообразными (азот, кислород), жидкими (бром) и твердыми (углерод, фосфор). В химических реакциях металлы обычно отдают электроны, т.е. проявляют положительные степени окисления. Между собой металлы, как правило, образуют не химические соединения определенного состава, а соединения переменного состава, называемые сплавами. Для металлов характерны химические реакции с неметаллами. Неметаллы в химических реакциях обычно принимают электроны и проявляют отрицательные степени окисления. Неметаллы могут реагировать как с металлами, так и между собой. Амфотерные гидроксиды) Основания и содержащие кислород кислоты имеют в своём составе гидроксидную группу (ОН), и называются гидроксидами. Например:
Различия в химических свойствах гидроксидов определяются различиями свойств атомов, с которыми связаны гидроксидные группировки ОН. Гидроксиды, образованные атомами с валентностью, равной 1,почти всегда являются основаниями. Большинство гидроксидов, образованных двухвалентными атомами, также относятся к основаниям. Гидроксиды, образованные атомами с валентностью от 4 до 8, относятся к кислотам. Если же валентность атомов равна 3, то их гидроксиды обычно являются амфотерными. Амфотерными являются также некоторые из гидроксидов двухвалентных и четырехвалентных атомов. Для кислот характерны следующие основные химические свойства: 1) взаимодействие с активными металлами с образованием солей и выделением водорода: H2SO4 + Mg = MgSO4 + H2; 2) взаимодействие с основаниями и амфотерными гидроксидами (реакция нейтрализации), в результате чего образуются соли и вода: HNO3 + NaOH = NaNO3 + H2O; 2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O; 3) взаимодействие с основными и амфотерными оксидами с образованием солей и воды: 2HCl + MgO = MgCl2 + H2O; 2HCl + ZnO = ZnCl2 + H2O. Наиболее типичными реакциями оснований являются: 1) взаимодействие с кислотами и амфотерными гидроксидами с образованием солей и воды (реакция нейтрализации): Са(OH)2 + H2SO4 = СаSO4 + H2O; Са(OH)2 + Zn(OH)2 = СаZnO2 + 2H2O; 2) взаимодействие с кислотными и амфотерными оксидами с образованием солей и воды: 2KOH + CO2 = K2CO3 + H2O; 2NaOH + Al2O3 = 2NaAlO2 + H2O. Амфотерные гидроксиды ведут себя в реакциях с кислотами как основания, а в реакциях с основаниями как кислоты. В таблице 3.1. приведены формулы и названия важнейших кислот и их солей и ряда оснований. Соли Соединения, содержащие в своём составе атомы металлов и кислотные остатки, называются солями. Соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металла. При полном замещении всех атомов водорода в молекуле кислоты образуются средние соли, например Na2SO4 – сульфат натрия. При частичном замещении атомов водорода образуются кислые соли, например NaHSO4 – гидросульфат натрия (устаревшее название – бисульфат натрия). Соли можно также рассматривать как продукты замещения гидроксидных групп в молекуле основания на кислотные остатки. При полном замещении всех гидроксидных групп образуются средние соли, например СаCl2. При частичном замещении образуются основные соли, например Ca(OH)Cl – гидроксохлорид кальция. Очевидно, что
Таблица 3.1. Формулы и названия некоторых оснований, кислот и их солей.
основные соли не могут быть образованы гидроксидами одновалентных металлов. Приведем некоторые химические свойства солей: 1) взаимодействие с растворимыми в воде основаниями (NaOH, КOH, Са(OH)2); реакции протекают в том случае, если образующийся гидроксид плохо растворим в воде.: Zn(NO3)2 + 2NaOH =2 NaNO3 + Zn(OH)2 ↓. Стрелка означает, что гидроксид цинка выпадает в осадок. 2) взаимодействие с кислотами; реакция протекает, если продукт реакции является летучим: Na2CO3 + H2SO4 = Na2SO4 + H2CO3; Угольная кислота неустойчива, легко разлагается на воду и летучий углекислый газ. Иначе реакция может быть записана так: Na2CO3 + H2SO4 = Na2SO4 + H2О + CO2↑. Стрелка означает, что углекислый газ улетучивается. 3) Соли взаимодействуют друг с другом, если один из продуктов реакции плохо растворим в воде: Na2CO3 + СаCl2 = СаCO3↓ + 2NaCl.
Основные понятия Степень окисления элементов в ходе химических реакций может не изменяться, и такие реакции называют обменными. Примерами обменных реакций могут быть реакции взаимодействия кислот и оснований (реакции нейтрализации). В то же время очень многие реакции сопровождаются изменением степеней окисления участвующих в них элементов, например: 2Mg + O2 = 2MgO. Степень окисления магния и кислорода до реакции равна нулю. В ходе реакции магний, как типичный металл отдаёт 2 электрона и приобретает заряд 2+, а кислород, как типичный неметалл принимает 2 электрона и приобретает заряд 2-. Эти процессы можно записать в виде схем: Mg - 2e → Mg2+, O + 2e → O2-. Процесс потери электронов называют окислением, а вещество, отдающее электроны является восстановителем; магний является восстановителем, он окисляется. Процесс принятия электронов называют восстановлением, а вещество, принимающее электроны является окислителем; атом кислорода является окислителем, он восстанавливается. Массовая доля Концентрация вещества – физическая величина (размерная или безразмерная), определяющая количественный состав раствора или смеси. Ниже будут рассмотрены два способа выражения концентрации растворов – массовая доля и молярная концентрация растворенного вещества. Массовая доля растворенного вещества В (символ ωВ, безразмерная величина) – равна отношению массы растворенного вещества В (mB) к массе раствора (mp):
Умножая массовую долю на сто, получают массовый процент растворенного вещества (В), называемый часто процентной концентрацией, хотя термин «процентная концентрация» не рекомендован к использованию. Масса раствора и объем связаны между собой соотношением: m = ρ∙V, (5.2.) где: m – масса раствора; V – объём раствора; ρ – плотность раствора. Отметим, что для приближенных расчётов плотность воды при температурах, не сильно отличающихся от 25оС, принимают равной 1 г/см3. Пример 5.1. Найти массу хлорида натрия и воды, содержащиеся в 300г раствора поваренной соли с массовой долей 0,06. Решение. Массовая доля 0,06 означает, что в 100г раствора содержится 6г NaCl. Следовательно: в 100г раствора содержится 6г NaCl, а в 300г “ “ “ х г “
Масса раствора равна сумме массы растворителя и растворенного вещества, следовательно, масса растворителя равна разности масс раствора и растворенного вещества 300 - 18 = 282г H2O. Пример 5.2. Какой объем воды потребуется для приготовления раствора сульфата натрия с массовой долей 0,01 исходя из 15г соли? Решение. Массовая доля соли равная 0,01 означает, что в 100г раствора содержится 1г растворенного вещества. 1г Na2SO4 содержится в 100г раствора 15г “ “ “ х г “ “
Масса раствора равна сумме массы растворителя и растворенного вещества, следовательно, масса растворителя равна разности масс раствора и растворенного вещества 1500 -15 = 1485г. Плотность воды принимаем ρ=1 г/см3, и, следовательно, объем воды численно равен её массе и составляет 1485 см3. Пример 5.3. Найти массы кристаллогидрата пентагидрата сульфата меди (медный купорос, CuSO4.5Н2О) и воды, необходимые для приготовления 400г 5 % раствора. Решение. Концентрация 5% означает, что в 100г раствора содержится 5г безводной соли, т.е. сульфата меди CuSO4 (концентрация всегда выражает содержание безводной соли). Следовательно, источником части воды, входящей в состав раствора будет кристаллогидрат CuSO4.5Н2О. Найдем массу безводной соли, используя пропорцию: 100г раствора содержат 5г CuSO4 400г “ “ x г “
Найдём массу кристаллогидрата, соответствующую 20г безводной соли, исходя из молярных масс CuSO4.5Н2О (М=250 г/моль) и CuSO4 (М=160 г/моль): 160г CuSO4 содержатся в 250г CuSO4.5Н2О 20г “ “ x г “
Следовательно, для приготовления 400г 5 % раствора CuSO4, необходимо взять 31,25г CuSO4.5Н2О и 400 – 31,25 = 368,75г воды. При этом в 400г раствора будет содержаться 20г CuSO4 и 380г воды. Пример 5.4. Найти массовую долю хлороводорода в растворе, полученном смешением 100 мл 5 % (ρ=1,023 г/см3) и 200 мл 20 % (ρ=1,098 г/см3) соляной кислоты. Решение. Найдём массы исходных растворов: m5%=100.1,023=102,3г; m10%=200.1,098=219,6г. Масса раствора после смешения составит: m=102,3+219,6=321,9г. Найдём массы HCl, содержащиеся в исходных растворах по формуле: mHCl=mр-р.ω. m=102,3.0,05=5,115г; m=219,6.0,20=43,92г. Масса хлороводорода в растворе после смешения составит: m= 5,115 + 43,92 = 49,035г, а массовая доля HCl будет:
Пример 5.5. В результате упаривания 500г 2 % раствора сульфата натрия получено 300г раствора. Найти массовую долю растворённого вещества в полученном растворе. Решение. В процессе упаривания из раствора улетучивалась вода, т.к. сульфат натрия практически не летуч. Следовательно, масса растворённого вещества не изменилась и составляет 500.0,02=10г Na2SO4. Массовая доля сульфата натрия в растворе после упаривания составит:
Пример 5.6. Какой объём 98 % серной кислоты (ρ=1,8365 г/см3) и воды потребуется для приготовления 1л 5 % раствора (ρ=1,0315 г/см3)? Решение. Найдём массу 1л 5 % раствора: m=1000.1,0315=1031,5г. Масса серной кислоты в 5 % растворе составит: m=1031,5.0,05=51,55г. Найдём массу 98% раствора, в которой содержится 65,75г серной кислоты: 100г 98 % раствора содержат 98г Н2SO4 х г “ “ “ 51,55г “
Объём 98 % раствора составит:
Определим массу воды, необходимую для приготовления раствора: m=1031,5 – 52,6 =978,9г. Принимая плотность воды равной 1,0 г/см3, получим объём воды, необходимый для приготовления 1л 5 % раствора, равный 978,9 мл. Пример 5.7. Какой объём 2% соляной кислоты (ρ=1,008 г/см3) потребуется для получения 0,2866г хлорида серебра в результате реакции с раствором нитрата серебра? Решение. Из уравнения реакции HCl + AgNO3 = AgCl↓ + HNO3 следует, что для получения 143,5г AgCl необходимо 36,5г HCl “ 0,2666г “ “ х г “
В 100г раствора содержится 2г HCl “ x г “ “ 0,0678г HCl
Объём 2% раствора соляной кислоты, необходимый для реакции, составит:
Контрольные вопросы и задачи
5.1. Сколько граммов серной кислоты содержится в 500г 10 % раствора? Ответ: 50г. 5.2. Какой объём воды необходим для приготовления 200г 5 % раствора хлорида калия? Ответ:190 см3. 5.3. Сколько граммов железного купороса (гептагидрат сульфата железа FeSO4 .7Н2О) необходимо для приготовления 600г 8 % раствора? Ответ: 87,8г. 5.4.H2SO4 в растворе, полученном смешением 50 мл 6 % (ρ=1,038 г/см3) и 250 мл 18 % (ρ=1,124 г/см3) серной кислоты. Ответ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 509; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.013 с.) |


 ); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) массу азотной кислоты, равную 63г; 4) количество вещества азотной кислоты, равное 1 моль (6,02.1023 формульных единиц). Химические формулы используются для разнообразных расчётов.
); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) массу азотной кислоты, равную 63г; 4) количество вещества азотной кислоты, равное 1 моль (6,02.1023 формульных единиц). Химические формулы используются для разнообразных расчётов. Можно также воспользоваться более удобной формулой:
Можно также воспользоваться более удобной формулой:

 ;
; .
.

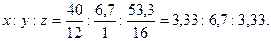


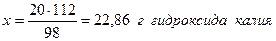
 ;
;
 Из уравнения реакции следует:
Из уравнения реакции следует:
 ,
,
 ;
; ;
;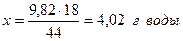 .
.



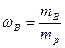 ( 5.1.)
( 5.1.)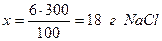 .
.
 .
.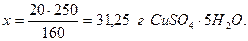
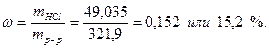
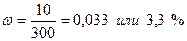 .
. .
.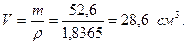
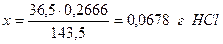 .
. .
. .
.


