
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнивание окислительно-восстановительных реакцийСодержание книги
Поиск на нашем сайте
Составление уравнений окислительно-восстановительных реакций основано на том, что число электронов, отданных восстановителем должно быть равно числу электронов, принятых окислителем. Рассмотрим метод составления уравнений, называемый методом электронного баланса, на примере реакции: KMnO4 + KNO2 + H2SO4 → K2SO4 + MnSO4 + KNO3 + H2O 1) Определим степени окисления элементов, образующих соединения, участвующие в реакции:
электроны и является окислителем, а степень окисления азота изменяется от (+3) до (+5), значит, азот отдаёт электроны и является восстановителем. Степени окисления других элементов не изменяются. 2) Составим полуреакции для процессов восстановления и окисления; при этом сумма зарядов левой и правой частей полуреакции должны быть равны: Mn+7 + 5e → Mn+2 |2 N+3 - 2e → N+5 |5 Из полуреакций следует, что для того чтобы число принятых электронов было равно числу отданных электронов, в реакции должно участвовать 2 атома Mn+7 и 5 атомов N+3. Коэффициенты 2 и 5 носят название фиксированных коэффициентов, т.к. при дальнейшем уравнивании они или не изменяются, либо изменяются одновременно в одно и то же число раз. 3) Проставим полученные коэффициенты перед KMnO4, KNO2, MnSO4, и KNO3: 2KMnO4 + 5KNO2 + H2SO4→ K2SO4 + 2MnSO4 + 5KNO3 + H2O Из полученной схемы следует, что в правой части имеем 3 сульфат-иона, а в левой части только один, следовательно, перед формулой серной кислоты необходимо поставить коэффициент 3: 2KMnO4 + 5KNO2 + 3H2SO4→ K2SO4 + 2MnSO4 + 5KNO3 + H2O. Из полученной схемы следует, что в левой части имеем 6 атомов водорода, а в правой части только два, следователь, перед формулой воды необходимо поставить коэффициент 3: 2KMnO4 + 5KNO2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5KNO3 +3H2O. Проверяем полученное выражение на равенство числа атомов каждого элемента в левой и правой части. Это условие соблюдено, следовательно, реакция уравнена, и поэтому ставим между левой и правой частями знак равенства. Контрольные вопросы и задачи 4.1. Определить степень окисления марганца в K2MnO4. Ответ: +6. 4.2. Определить степень окисления хлора в KClO4 . Ответ: +7. 4.3. Определить степень окисления серы в K2S. Ответ: -2. 4.4. Определить степень окисления азота в ионе аммония NH4.+ Ответ: -3. 4.5. Определить степень окисления фосфора в Na4P2O7. Ответ: +5. 4.6. Уравнять реакцию: SO2 + Br2+H2O → HBr + H2SO4. 4.7. Уравнять реакцию: Cu + H2SO4 → CuSO4 + SO2 + H2O. 4.8. Уравнять реакцию: KMnO4 + KOH → K2MnO4 + O2 + H2O. 4.9. Уравнять реакцию: K2Cr2O7 +H2S + H2SO4 → Cr2 (SO4)3 + S + K2SO 4 + H2O. 4.10. Уравнять реакцию: Zn + KNO3 + KOH → K2ZnO2 + KNO2 +H2O. 4.11. Уравнять реакцию: Cl2 + KOH → KClO3 + KCl + H2O. 4.12. Уравнять реакцию: N2H4 + NaOH + Zn → NN3 + Na2ZnO2. 4.13. Уравнять реакцию: KMnO4 + H2O2 + H2SO4 → K2 SO4 + MnSO4 + O2 + H2O.
Способы выражения концентраций растворов Массовая доля Концентрация вещества – физическая величина (размерная или безразмерная), определяющая количественный состав раствора или смеси. Ниже будут рассмотрены два способа выражения концентрации растворов – массовая доля и молярная концентрация растворенного вещества. Массовая доля растворенного вещества В (символ ωВ, безразмерная величина) – равна отношению массы растворенного вещества В (mB) к массе раствора (mp):
Умножая массовую долю на сто, получают массовый процент растворенного вещества (В), называемый часто процентной концентрацией, хотя термин «процентная концентрация» не рекомендован к использованию. Масса раствора и объем связаны между собой соотношением: m = ρ∙V, (5.2.) где: m – масса раствора; V – объём раствора; ρ – плотность раствора. Отметим, что для приближенных расчётов плотность воды при температурах, не сильно отличающихся от 25оС, принимают равной 1 г/см3. Пример 5.1. Найти массу хлорида натрия и воды, содержащиеся в 300г раствора поваренной соли с массовой долей 0,06. Решение. Массовая доля 0,06 означает, что в 100г раствора содержится 6г NaCl. Следовательно: в 100г раствора содержится 6г NaCl, а в 300г “ “ “ х г “
Масса раствора равна сумме массы растворителя и растворенного вещества, следовательно, масса растворителя равна разности масс раствора и растворенного вещества 300 - 18 = 282г H2O. Пример 5.2. Какой объем воды потребуется для приготовления раствора сульфата натрия с массовой долей 0,01 исходя из 15г соли? Решение. Массовая доля соли равная 0,01 означает, что в 100г раствора содержится 1г растворенного вещества. 1г Na2SO4 содержится в 100г раствора 15г “ “ “ х г “ “
Масса раствора равна сумме массы растворителя и растворенного вещества, следовательно, масса растворителя равна разности масс раствора и растворенного вещества 1500 -15 = 1485г. Плотность воды принимаем ρ=1 г/см3, и, следовательно, объем воды численно равен её массе и составляет 1485 см3. Пример 5.3. Найти массы кристаллогидрата пентагидрата сульфата меди (медный купорос, CuSO4.5Н2О) и воды, необходимые для приготовления 400г 5 % раствора. Решение. Концентрация 5% означает, что в 100г раствора содержится 5г безводной соли, т.е. сульфата меди CuSO4 (концентрация всегда выражает содержание безводной соли). Следовательно, источником части воды, входящей в состав раствора будет кристаллогидрат CuSO4.5Н2О. Найдем массу безводной соли, используя пропорцию: 100г раствора содержат 5г CuSO4 400г “ “ x г “
Найдём массу кристаллогидрата, соответствующую 20г безводной соли, исходя из молярных масс CuSO4.5Н2О (М=250 г/моль) и CuSO4 (М=160 г/моль): 160г CuSO4 содержатся в 250г CuSO4.5Н2О 20г “ “ x г “
Следовательно, для приготовления 400г 5 % раствора CuSO4, необходимо взять 31,25г CuSO4.5Н2О и 400 – 31,25 = 368,75г воды. При этом в 400г раствора будет содержаться 20г CuSO4 и 380г воды. Пример 5.4. Найти массовую долю хлороводорода в растворе, полученном смешением 100 мл 5 % (ρ=1,023 г/см3) и 200 мл 20 % (ρ=1,098 г/см3) соляной кислоты. Решение. Найдём массы исходных растворов: m5%=100.1,023=102,3г; m10%=200.1,098=219,6г. Масса раствора после смешения составит: m=102,3+219,6=321,9г. Найдём массы HCl, содержащиеся в исходных растворах по формуле: mHCl=mр-р.ω. m=102,3.0,05=5,115г; m=219,6.0,20=43,92г. Масса хлороводорода в растворе после смешения составит: m= 5,115 + 43,92 = 49,035г, а массовая доля HCl будет:
Пример 5.5. В результате упаривания 500г 2 % раствора сульфата натрия получено 300г раствора. Найти массовую долю растворённого вещества в полученном растворе. Решение. В процессе упаривания из раствора улетучивалась вода, т.к. сульфат натрия практически не летуч. Следовательно, масса растворённого вещества не изменилась и составляет 500.0,02=10г Na2SO4. Массовая доля сульфата натрия в растворе после упаривания составит:
Пример 5.6. Какой объём 98 % серной кислоты (ρ=1,8365 г/см3) и воды потребуется для приготовления 1л 5 % раствора (ρ=1,0315 г/см3)? Решение. Найдём массу 1л 5 % раствора: m=1000.1,0315=1031,5г. Масса серной кислоты в 5 % растворе составит: m=1031,5.0,05=51,55г. Найдём массу 98% раствора, в которой содержится 65,75г серной кислоты: 100г 98 % раствора содержат 98г Н2SO4 х г “ “ “ 51,55г “
Объём 98 % раствора составит:
Определим массу воды, необходимую для приготовления раствора: m=1031,5 – 52,6 =978,9г. Принимая плотность воды равной 1,0 г/см3, получим объём воды, необходимый для приготовления 1л 5 % раствора, равный 978,9 мл. Пример 5.7. Какой объём 2% соляной кислоты (ρ=1,008 г/см3) потребуется для получения 0,2866г хлорида серебра в результате реакции с раствором нитрата серебра? Решение. Из уравнения реакции HCl + AgNO3 = AgCl↓ + HNO3 следует, что для получения 143,5г AgCl необходимо 36,5г HCl “ 0,2666г “ “ х г “
В 100г раствора содержится 2г HCl “ x г “ “ 0,0678г HCl
Объём 2% раствора соляной кислоты, необходимый для реакции, составит:
Контрольные вопросы и задачи
5.1. Сколько граммов серной кислоты содержится в 500г 10 % раствора? Ответ: 50г. 5.2. Какой объём воды необходим для приготовления 200г 5 % раствора хлорида калия? Ответ:190 см3. 5.3. Сколько граммов железного купороса (гептагидрат сульфата железа FeSO4 .7Н2О) необходимо для приготовления 600г 8 % раствора? Ответ: 87,8г. 5.4.H2SO4 в растворе, полученном смешением 50 мл 6 % (ρ=1,038 г/см3) и 250 мл 18 % (ρ=1,124 г/см3) серной кислоты. Ответ: 0,16. 5.5. Найти массовую долю хлорида в растворе, полученном растворением 2г KCl в 300 см3 5 % раствора хлорида калия (ρ=1,030 г/см3). Ответ: 0,108. 5.6. Какие объёмы 50 % азотной кислоты (ρ=1,310 г/см3) и воды необходимо смешать для получения 1/2 л 10 % раствора HNO3 (ρ=1,054 г/см3)? Ответ: 80,5 мл 50 % HNO3 и 421,6 мл Н2О. 5.7. Какой объём 10% HNO3 (ρ=1,054 г/см3) потребуется для растворения 10г карбоната кальция? Ответ: 119,5 мл.
Основной курс Введение
Химия относится к естественным наукам. Предметом изучения химии является состав, свойства и структура веществ, законы превращения одних веществ в другие. Химия _ это наука о взаимных превращениях веществ. Химия играет важнейшую роль в жизни человечества. Производство химических удобрений, средств защиты растений и животных позволило решить проблему производства продуктов питания. Создание и производство синтетических лекарственных препаратов позволило резко сократить смертность и увеличить среднюю продолжительность жизни человека. Создание и производство искусственных и синтетических волокон и пленок решило проблему одежды и обуви. Прогресс всех отраслей техники основан, прежде всего, на создании химической наукой материалов с особыми свойствами. Отсюда вытекает важность изучения химии для современного специалиста в любой области техники.
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 361; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.214.16 (0.007 с.) |

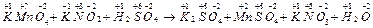 Из схемы следует, что в ходе реакции степень окисления марганца изменяется от (+7) до (+2), следовательно, марганец принимает
Из схемы следует, что в ходе реакции степень окисления марганца изменяется от (+7) до (+2), следовательно, марганец принимает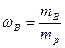 ( 5.1.)
( 5.1.)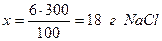 .
.
 .
.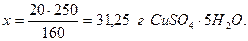
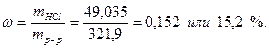
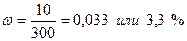 .
. .
.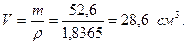
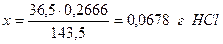 .
. .
. .
.


