
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количество вещества равно отношению массы вещества, выраженной в граммах или килограммах к молярной массе веществаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пример 1.2. Найти количество вещества серной кислоты, если масса серной кислоты составляет 500г. Решение.
Согласно закону Авогадро: В равных объемах любых газов при одинаковых давлении и температуре содержится одинаковое число молекул. Из закона Авогадро следует, что при температуре 273К (0оС) и давлении 101325 Па (нормальные условия) 1 моль любого газа занимает объем 22,4 дм3 (л). Эта величина носит название молярный объем (VB). Объем газа, находящегося при произвольных ус ловиях, может быть приведен к нормальным условиям с использованием формулы Менделеева-Клапейрона
где р _ давление газа; V _ объем газа; mB _ масса газа; МВ _ молярная масса газа; Т – температура в градусах термодинамической шкалы Кельвина (К); R _ универсальная газовая постоянная, равная 8,314 Дж/(моль.К), или (л.кПа)/(моль.К) в СИ, или 0,08206 (л.атм)/(моль.К), если давление выражено в атмосферах, или 62,36 (л.мм рт. ст.)/(моль.К), если давление выражено в мм ртутного столба. Пример 1.3. Найти количество вещества углекислого газа, если его объем при нормальных условиях составляет 5 дм3. Решение. Составим пропорцию: 1 моль газа занимает объем 22,4л х моль газа занимает объем 5л
Постоянная Авогадро может быть использована для нахождения числа формульных единиц вещества*, числа атомов и т.п. Пример 1.4. Найти число формульных единиц серной кислоты, число атомов водорода, серы и кислорода, содержащихся в 1000 г H2SO4. Решение. Найдем количество вещества серной кислоты, используя формулу (1.1):
Составим пропорцию:
* Термин «формульная единица» может быть использован в тех случаях, когда термин «молекула» не соответствует реальным структурным единицам вещества. Так в кристаллической поваренной соли невозможно выделить отдельные молекулы NaCl. Поэтому вместо термина «молекула NaCl» правильнее использовать термин «формульная единица NaCl», как отражающий состав соединения. Сказанное применимо и к серной кислоте.
1 моль серной кислоты содержит 6,02.1023 формульных единиц H2SO4
10,2 моль - “ - - “- х - “- - “-
Одна формульная единица серной кислоты содержит 2 атома водорода, следовательно, 1000г или 10,2 моль серной кислоты содержат 2.6,14.1024=1,228.1025 атомов водорода. Соответственно, число атомов серы и кислорода составит: 1.6,14.1024=6,14.1024 атомов серы и 4.6,14.1024=2,456.1025 атомов кислорода.
Химические формулы Химические формулы выражают количественный и качественный состав соединения и, одновременно, обозначают массу, соответствующую 1 моль вещества. Например, формула азотной кислоты HNO3 означает: 1) это вещество образовано 1 атомом водорода, 1 атомом азота и 3 атомами кислорода или одним ионом водорода (Н+) и одним нитрат-ионом ( Пример 1.5. Найти процентное содержание кальция, водорода и кислорода в гидроксиде кальция Са(OН)2. Решение. Найдем молярную массу гидроксида кальция. Для этого в таблице ПСЭМ найдем относительные атомные массы кальция, кислорода и водорода и подставим их в формулу:
Для нахождения процентного содержания кальция составим пропорцию: 74г Са(OН)2 содержат 40г кальция 100г - “ - - “ - х - “ – Следовательно, процентное содержание кальция в Са(OН)2 составит:
Аналогично находим процентное содержание водорода и кислорода: 74г Са(OН)2 содержат 2г водорода 100г - “ - - “ - х г - “ –
74г Са(OН)2 содержат 32г кислорода 100г - “ - - “ - х г - “ –
Проверим правильность вычислений. Суммарное содержание всех трех элементов в гидроксиде кальция составляет: 54,05+2,70+43,24=99,99 % Отклонение полученной величины от 100 % на 0,01% связано с округлением результатов. Пример 1.6. Найти массу одной формульной единицы (молекулы) хлорида натрия (поваренной соли). Решение. 1 моль NaCl содержит 6,02.1023 формульных единиц (молекул). Молярная масса хлорида натрия составляет
Составим пропорцию: Масса 6,02.1023 молекул NaCl составляет 58,5г Масса 1 - “ - - “ - - “ - - “ - х г
Пример 1.7. Найти простейшую формулу соединения, содержащего (по массе) 40 % углерода, 6,7 % водорода, 53,3 % кислорода, если плотность его паров по водороду составляет 15. Решение. Обозначим числа атомов углерода, водорода и кислорода в простейшей формуле соединения через x, y и z. Молекулярные массы этих элементов равны 12, 1 и 16. Поэтому массы углерода, водорода и кислорода в составе соединения относятся как 12x:1y:16z. По условиям задачи это отношение равно 40:6,7:53,3. Следовательно, 12x:y:16z=40:6,7:53,3, откуда Чтобы выразить полученное отношение целыми числами, разделим его члены на меньший из них:
Таким образом, простейшая формула соединения - СН2О. Молекулярная масса соединения Мr=12+2+16=30. Молекулярная масса, определенная по относительной плотности, составляет М = 2.15=30. Следовательно, простейшая и истинная формулы соединения совпадают. Химические уравнения
Химические уравнения показывают вещества, вступающие в химическую реакцию и образующиеся в результате продукты, а также количественные отношения между всеми участниками реакции. Например, уравнение 2HCl + Ca(OH)2 = CaCl2 + 2H2O означает, что в реакцию вступают 2 моль соляной кислоты и 1 моль гидроксида кальция; образуется 1 моль хлорида кальция и 2 моль воды, а массы исходных веществ и продуктов реакции удовлетворяют соотношению:
Пример 1.8. Серная кислота (H2SO4) реагирует с гидроксидом калия по уравнению H2SO4 + 2KOH = K2SO4 + 2H2O Найти массу гидроксида калия, необходимую для реакции с 20г серной кислоты и массы сульфата калия и воды, образующиеся в результате реакции. Решение. Молярные массы участников реакции составляют, соответственно: 98 (H2SO4); 56 (KOH); 176 (K2SO4) и 8 (H2O) г/моль. Из уравнения реакции следует, что 1 моль серной кислоты реагирует с 2 моль гидроксида калия или 98г H2SO4 взаимодействуют с 2.56=112г KOH. Составим пропорцию: 98г H2SO4 реагируют со 112г КОН 20г - “ - - “ - х г - “ -
Аналогично в соответствии с уравнением реакции запишем: Из 98г H2SO4 образуется 176г K2SO4 Из 20г - “ - - “ - х г - “ -
Из 98г H2SO4 образуется 36г Н2O Из 20г - “ - - “ - х г - “ –
Пример 1.9. При взаимодействии серной кислоты и карбоната натрия выделилось 5,0л углекислого газа (н.у.). Найти массы серной кислоты и карбоната натрия, взятые для реакции, а также массу сульфата натрия, образовавшуюся в результате реакции. Решение. Запишем уравнение реакции: H2SO4 + Na2CO3 = Na2SO4 + CO2 + H2O Из уравнения реакции следует, что в реакцию вступают 1 моль серной кислоты и 1 моль карбоната натрия и образуется по 1 моль сульфата натрия, углекислого газа и воды. Иначе говоря, в реакцию вступают 98г H2SO4 и106 г Na2CO3, а образуется 142г Na2SO4, 44г CO2 и 18г H2O. Один моль углекислого газа, или 44г, занимают при нормальных условиях объем 22, 4 дм3(л). Молярные массы участников реакции составят: Для получения 22,4л CO2 необходимо взять 98г H2SO4 - “ - - “ - 5л - “ - - “ - х г - “ -
Количество углекислого газа можно выразить в граммах: масса 22,4 л CO2 составляет 44 г - “ - 5 л - “ - - “ - х г
и при последующих вычислениях использовать массу газа, а не объём. Основываясь на уравнении реакции, найдём массы Na2CO3, Na2SO4 и H2O: Для получения 44г CO2 необходимо взять 106г Na2CO3 - “ - - “ - 9,82г - “ - - “ - х г - “ –
при получении 44г CO2 образуется 142г Na2SO4 - “ - - “ - 9,82г - “ - - “ - х г - “ –
при получении 44г CO2 образуется 18г H2O - “ - - “ - 9,82г - “ - - “ - х г - “ –
Контрольные вопросы и задачи 1.1.Найти количество вещества азотной кислоты, если её масса составляет 100г. Ответ: 1,59 моль. 1.2. Найти количество вещества азота, если его объем при нормальных условиях составляет 15 дм3. Ответ: 0,67 моль. 1.3. Найти число формульных единиц гидрокарбоната кальция, число атомов кальция, водорода, углерода и кислорода, содержащихся в 300г Ca(HCO3)2. Ответ: 1.4. Найти процентное содержание магния, азота и кислорода в нитрате магния Mg(NO3)2. Ответ: ωMg=16,2; ωN=18,9; ωMg=64,9%. 1.5.Найти массу одной молекулы хлора. Ответ:1,18.10-22г. 1.6. Найти массу гидроксида кальция, необходимую для реакции с 10г соляной кислоты и массы хлорида кальция и воды, образующиеся в результате реакции 2HCl + Ca(OH)2 = CaCl2 + 2H2O. Ответ: 1.7. Найти массу оксида кальция, воды и объем углекислого газа, образующихся при термическом разложении 200г гидрокарбоната кальция по реакции: Сa(HCO3)2=CaO+H2O+2 CO2. Ответ:
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 581; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.01 с.) |

 (1.1)
(1.1)
 (1.2.)
(1.2.) ;
; 

 H2SO4
H2SO4 ); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) массу азотной кислоты, равную 63г; 4) количество вещества азотной кислоты, равное 1 моль (6,02.1023 формульных единиц). Химические формулы используются для разнообразных расчётов.
); 2) на 1 массовую часть водорода в азотной кислоте приходится 14 массовых частей азота и 48 массовых частей кислорода; 3) массу азотной кислоты, равную 63г; 4) количество вещества азотной кислоты, равное 1 моль (6,02.1023 формульных единиц). Химические формулы используются для разнообразных расчётов. Можно также воспользоваться более удобной формулой:
Можно также воспользоваться более удобной формулой:

 ;
; .
.

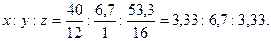


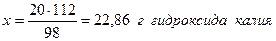
 ;
;
 Из уравнения реакции следует:
Из уравнения реакции следует:
 ,
,
 ;
; ;
;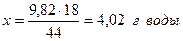 .
.





