
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролитическая диссоциация гидроксидов и солейСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В водных растворах гидроксиды и соли проводят электрический ток в результате распада на заряженные частицы – ионы. Этот процесс носит название электролитическая диссоциация, а вещества, распадающиеся на ионы в водном растворе, называются электролитами. Кислотами, с точки зрения теории электролитической диссоциации, называют вещества, распадающиеся в водных растворах на положительно заряженные ионы водорода (Н+) и отрицательно заряженные ионы кислотного остатка. Например, соляная кислота дисссоциирует по уравнению: HCl↔H+ + Cl- Положительно заряженные ионы носят название катионы, а отрицательно заряженные – анионы. Таким образом, при диссоциации соляной кислоты образуется катион водорода и анион хлора (хлорид-ион). Число ионов водорода, образующихся при полной диссоциации молекулы кислоты, называется основностью кислоты. Так, соляная кислота является одноосновной, а серная кислота – двухосновная, т.к. при её диссоциации образуются два иона водорода:
Электролиты могут диссоциировать (распадаться на ионы) полностью и такие вещества называют сильными электроли тами.Электролиты, диссоциирующие частично, называют слабыми или средними. Серная, азотная и соляная кислоты относятся к сильным электролитам (сильным кислотам), а угольная кислота является слабой кислотой (слабым электролитом). Основаниями, с точки зрения теории электролитической диссоциации, называют вещества, распадающиеся в водных растворах на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы (ОН-). Например, гидроксид натрия дисссоциирует по уравнению: NaOH↔Na+ + OH-. Число гидроксид-ионов, образующихся при полной диссоциации молекулы основания, называется кислотностью основания. Так, гидроксид натрия является однокислотным, а гидрокисид кальция – двухкислотным: Ca(OH)2 ↔ Ca2+ + 2OH-. Основания, как и все электролиты могут быть сильными, слабыми и средней силы. Гидроксиды натрия, калия и кальция являются сильными основаниями, а гидроксид аммония – слабое основание. Амфотерные гидроксиды могут диссоциировать как кислоты и как основания: Zn(OH)2 ↔ Zn2+ + 2OH-; Zn(OH)2 ↔ 2H+ + ZnO22-. В реакциях с кислотами амфотерные гидроксиды диссоциируют как основания, а в реакциях с основаниями – как кислоты. Средние соли в водных растворах диссоциируют на катионы металла и анионы кислотного остатка:
Кислые соли могут диссоциировать частично:
или полностью с образованием кроме иона металла также катиона водорода:
Соответственно, основные соли также могут диссоциировать частично или полностью: CaOHCl ↔ CaOH+ + + Cl-; CaOHCl ↔ Ca2+ + OH- + Cl-. Большинство солей являются сильными электролитами.
Контрольные вопросы и задачи 3.1. Какие элементы 3-го периода ПСЭМ относятся к металлам? Ответ: натрий, магний, алюминий. 3.2.Какие элементы 4-й группы главной подгруппы относятся к неметаллам, полуметаллам, неметаллам? Ответ: углерод, кремний - неметаллы, германий – полуметалл, олово и свинец – металлы. 3.3.Напишите уравнения реакций цинка (валентность 2), фосфора (валентность 5) и титана (валентность 4) с кислородом. 3.4.Напишите уравнения реакций кальция, фосфора (валентность 3), и калия с хлором. 3.5. Напишите уравнение реакции взаимодействия оксида фосфора(V) и оксида магния с водой. 3.6. Напишите уравнение реакции взаимодействия оксида магния с оксидом углерода (IV). 2.7. Напишите уравнения реакций взаимодействия оксида алюминия с оксидом натрия и оксидом серы (VI). 3.8. Напишите уравнение реакции взаимодействия соляной кислоты с алюминием. 3.9. Напишите уравнение реакции взаимодействия азотной кислоты с оксидом алюминия. 3.10. Напишите уравнения реакций взаимодействия серной кислоты с гидроксидом калия и гидроксидом железа (II). 3.11. Напишите уравнение реакции взаимодействия гидроксида аммония с соляной кислотой. 3.12. Напишите уравнение реакции взаимодействия гидроксида натрия с оксидом серы (VI) и оксидом цинка (валентностьцинка - 2). 3.13. Напишите уравнение реакции взаимодействия сульфата железа (III) с едким натром, зная, что гидроксид железа (III) не растворим в воде. 3.14. Напишите уравнение реакции взаимодействия соляной кислоты с сульфитом натрия (Na2SO3), зная, что сернистая кислота неустойчива, и разлагается на воду и газообразный оксид серы (IV). 3.15. Напишите уравнение реакции взаимодействия сульфата натрия с хлоридом кальция, зная, что сульфат кальция не растворим в воде. 3.16. Напишите уравнения электролитической диссоциации азотной кислоты, гидроксида калия и хлорида магния. 3.17. Напишите уравнения электролитической диссоциации угольной кислоты, гидроксида магния и сульфата алюминия. 3.18. Напишите уравнения электролитической диссоциации фосфорной кислоты (H3PO4), гидроксида бария (Ba(OH)2) и нитрата магния.
|
||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 1919; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.006 с.) |


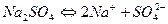 .
.
 .
.


