
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Недостатки теории электролитической диссоциации АррениусаСодержание книги
Поиск на нашем сайте
В качестве одной из количественных характеристик электролита теория Аррениуса предлагает степень электролитической диссоциации a, определяющую долю ионизированных молекул в данном растворе. В согласии с ее физическим смыслом a не может быть больше 1 или меньше 0; при заданных условиях она должна быть одной и той же, независимо от метода ее измерения (по измерению электропроводности, осмотического давления или ЭДС). Однако на практике значения a, полученные разными методами, совпадают только для разбавленных растворов слабых электролитов; для сильных электролитов расхождение тем больше, чем больше концентрация электролита, причем в области высоких концентраций a становится больше 1. Следовательно, a не может иметь того физического смысла, который ей приписывался теорией Аррениуса. Второй количественной характеристикой по теории Аррениуса является константа диссоциации; она должна быть постоянной для данного электролита при заданных Т и р, независимо от концентрации раствора. На практике только для разбавленных растворов очень слабых электролитов Кдис остается при разбавлении более или менее постоянной. Таким образом, теория электролитической диссоциации приложима только к разбавленным растворам слабых электролитов. Существенным недостатком теории Аррениуса является и то, что она не указывает причин, вызывающих ионизацию электролитов в растворах. Термин «электролитическая диссоциация» подразумевает образование ионов в растворе при распаде нейтральных молекул растворяемого вещества. Однако часто ионы существуют уже до растворения: кристаллы солей построены из ионов, и при растворении должно произойти разрушение кристалла. Расчеты энергии кристаллической решетки DGp (энергия кристаллической решетки – это работа, которую нужно затратить для разрушения решетки, то есть для разведения составляющих ее ионов на бесконечно большое расстояние в вакууме) показывают, что количество термической энергии при обычных температурах слишком мало по сравнению с тем, которое надо затратить на разрушение решетки. Одно из первых (и одно из наиболее точных) уравнений для подсчета энергии решетки – уравнение Борна (1918): DGp = NA КМ – константа Маделунга, зависящая от характера взаимного расположения ионов в кристаллической решетке; ее значения известны для различных типов решетки, например, для NaCl (ГЦК-решетка) КМ = 1,7476;
r – равновесное расстояние между ионами противоположного знака в данном кристалле; обычно оно определяется по принципу плотной упаковки и отвечает сумме кристаллохимических радиусов Гольдшмидта; n – константа, характеризующая изменение сил отталкивания с расстоянием между частицами; рассчитывается из данных по сжимаемости кристаллов; она лежит в пределах от 5 до 12 (для NaCl n = 7,5):
где b – коэффициент сжимаемости кристалла. А.Ф.Капустинский предложил следующие два уравнения (1933, 1943), несколько менее точные, чем формула Борна, но более универсальные и не требующие определения величин КМ и n: DGp = 1072,2×10–10 n DGp = 1202,4×10–10 n где n – число ионов в молекуле данного соединения; r + , r – – радиусы положительных и отрицательных ионов, м. Воспользуемся приведенными уравнениями для оценки энергии решетки NaCl, подставив численные значения. Формула Борна дает для энергии решетки DGp = Первая формула Капустинского приводит к величине несколько большей, чем вычисленная по Борну: DGp = 1072,2×10–10 ×2 а вторая формула Капустинского дает результат несколько меньший: DGp = 1202,4×10–10 ×2 755 кДж/моль. Как было показано Б орном и Габером (1919), энергию решетки можно найти из термохимических данных, если воспользоваться циклом, основанным на законе Гесса. Подобный цикл можно составить для любого кристаллического вещества. Для NaCl цикл имеет вид:
Na (тв) + ½ Cl2 (газ) DGобр – энергия образования хлорида натрия из элементарных натрия и хлора, взятых в их стандартных состояниях (твердый кристаллический натрий и газообразный молекулярный хлор); DGсуб – энергия сублимации натрия; DGион – энергия ионизации натрия; DGдис – энергия диссоциации молекулярного хлора; DGср – энергия, характеризующая сродство электрона к газообразному атомарному хлору. DGр = – DGобр + DGсуб + DGион + DGдис + DGср = – (– 384) + 78 + 496 + 203 – 387 = 774 кДж/моль. Полученное значение достаточно хорошо согласуется с энергией решетки, подсчитанной по уравнениям Борна и Капустинского.
В кристаллической решетке соседние ионы Na+ и Cl– по сравнению с изолированной молекулой NaCl обладают меньшим числом степеней свободы, поэтому тепловую энергию молекулы NaCl можно рассматривать как ее максимальное значение для пары противоположно заряженных ионов в решетке. Свободная молекула NaCl обладает семью степенями свободы, то есть при 298К запас ее тепловой энергии составляет 8,68 кДж/моль, из которой всего лишь около 2,5 кДж/моль приходится на колебательную энергию, непосредственно вызывающую распад молекул. Это количество термической энергии слишком мало по сравнению с тем, которое надо затратить на разрушение решетки (762 кДж/моль), чтобы обеспечить сколько-нибудь заметную диссоциацию хлорида натрия на ионы. В то же время известно, что в водном растворе NaCl a» 1. Наиболее полная и четкая формулировка основных недочетов теории Аррениуса и путей их преодоления дана в трудах Д.И.Менделеева. Причина всех недостатков теории заключается в игнорировании взаимодействия частиц растворенного вещества между собой, а также с молекулами растворителя. Менделеев отмечал, что для растворов существенны не только процессы диссоциации, но и процессы образования новых соединений с участием молекул растворителя. Эти взгляды Менделеева были развиты Д.П.Коноваловым, И.А.Каблуковым, В.А.Кистяковским, Л.В.Писаржевским, А.Нойесом и легли в основу современной теории растворов. В теории Аррениуса ионы рассматривались как частицы идеального газа, а следовательно, не учитывались обусловленные кулоновскими силами притяжение катионов и анионов и отталкивание одноименно заряженных ионов. Пренебрежение ион-ионным взаимодействием, совершенно непонятное с физической точки зрения, и приводило к нарушению количественных соотношений теории Аррениуса, о чем уже говорилось выше (константа диссоциации не оставалась постоянной, а изменялась при изменении концентрации электролита, что особенно отчетливо проявлялось в растворах сильных электролитов – так называемая «аномалия сильных электролитов»; различные методы определения степени диссоциации a давали несовпадающие результаты, а в концентрированных растворах сильных электролитов иногда получались не имеющие физического смысла значения a > 1 и др.). Если в раствор ввести большой избыток постороннего электролита (так называемого «фона»), который не участвует непосредственно в ионных равновесиях, то в этих условиях основные соотношения теории Аррениуса выполняются с очень хорошей степенью приближения. Метод введения избытка индифферентного электролита был предложен Я.Брёнстедом и получил название метода постоянной ионной среды. Если игнорировать ион-дипольное взаимодействие (то есть взаимодействие ионов с диполями воды или другого растворителя), то нельзя объяснить процесс образования ионов и устойчивость ионных систем, ведь именно это взаимодействие, как показано далее, является физической основой образования ионов в растворе при растворении электролита. Вопрос о причинах электролитической диссоциации вскрывает наиболее уязвимые места теории Аррениуса.
|
||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 685; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.157.7 (0.007 с.) |

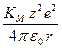
 ,
,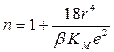 ,
,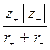 ,
,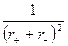 ,
,
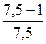 = 762 кДж/моль.
= 762 кДж/моль.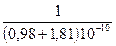 = 769 кДж/моль,
= 769 кДж/моль, – 414,8×10–20 ×2
– 414,8×10–20 ×2 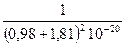 =
= NaCl (кр)
NaCl (кр)  Na+(газ) + Cl–(газ)
Na+(газ) + Cl–(газ)



