
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение реальных энергий гидратации ионовСодержание книги
Поиск на нашем сайте Идея метода нахождения DGs(реал) отдельного вида ионов была выдвинута А.Н.Фрумкиным и реализована Дж.Рэндлсом.
2. Ионизируем эти атомы в точке 1 вблизи поверхности металла, затратив на это работу DGион . Электроны возвращаются в металл, что дает выигрыш в энергии z 3. Ионы металла Mz+ из точки 1 переведем в точку 2. Поскольку между этими точками существует разность потенциалов VM,L, то при этом будет затрачена работа NA ze oVM,L = zF VM,L . 4. Ионы металла внесем в раствор. Соответствующий этому процессу энергетический эффект равен реальной энергии сольватации ионов DGs(реал). 5. Для завершения цикла перенесем ионы Mz+ из раствора в металл. В условиях электрохимического равновесия работа этого процесса равна нулю. При обратимом и изотермическом проведении цикла суммирование дает в согласии с законом Гесса DGсубл + DGион – z и, следовательно, DGs(реал) = – DGсубл – DGион + z Все величины в правой части этого уравнения доступны экспериментальному определению, и это открывает путь для расчета реальной энергии сольватации отдельного вида ионов. В таблице 4 приведены значения DGs(реал) для некоторых ионов, рассчитанные по наиболее надежным данным Дж. Рэндлса. Таблица 4 Опытные данные о величинах реальной энергии гидратации некоторых ионов
В литературе используется также приведенная шкала, в которой за ноль принимаются термодинамические величины для иона водорода. Расчеты любых энергий в такой шкале основаны на последовательном рассмотрении сольватации кислот и солей. Например, из свободной энергии (или энтальпии) для HCl определяют парциальные величины для хлорид-иона. Затем используют их в комбинации с данными для NaCl и определяют парциальные величины для катиона натрия и т.д. Выбор в качестве точки отсчета именно иона водорода определяется тем обстоятельством, что для него возможно относительно точное экспериментальное определение DGs(реал) методом масс-спектрометрии. Энтропия сольватации ионов Реальная и химическая энергии сольватации соли совпадают, и, суммируя величины DGs(реал) для катионов и анионов, можно получить энергию сольватации соли, а затем сопоставить ее с соответствующей теплотой сольватации. Разность DHs(соли) – DGs(соли) = TDSs(соли) позволяет рассчитать энтропии сольватации соли DSs(соли). Различия между теплотами и энергиями гидратации незначительны, что указывает на малую энтропию гидратации. Энтропии гидратации солей отрицательны. Отсюда следует, что при введении ионов структура воды становится более упорядоченной из-за ориентирующего действия ионов на ближайшие к иону диполи воды. Такой вывод подтверждается слабо выраженным и почти линейным уменьшением диэлектрической проницаемости раствора e при увеличении концентрации электролита вплоть до 0,5 – 1,0 М растворов. Дальнейшее повышение концентрации приводит к некоторому замедлению спада e и отклонению экспериментальной кривой от прямой линии в сторону больших величин e. Предполагается, что такой ход кривых e – с обусловлен наложением эффектов упорядочения структуры воды и ее разрушения под действием введенных ионов. Если рассматривать воду как систему, состоящую из квазикристаллических образований, то при введении первых порций электролита наиболее заметно проявляется их упорядочивающее действие – образование внутреннего сольватного слоя молекул воды, частичная ориентация молекул воды во внешнем сольватном слое, уменьшение свободного объема жидкости. Все эти эффекты охватывают главным образом преобладающую аморфную форму воды, связь между молекулами в которой слабее, чем в квазикристаллических образованиях, и приводит к уменьшению энтропии. При возрастании концентрации электролита, когда значительная часть аморфной воды становится связанной, в формирование гидратных оболочек вовлекаются квазикристаллические образования, их упорядоченность снижается, а энтропия возрастает. Энтропии сольватации отдельных ионов экспериментально определить невозможно. Чтобы разделить суммарные величины DSs(соли) на составляющие их энтропии DSs+ и DSs–, пользуются модельными допущениями. Наряду с чисто электростатическим, между ионами раствора и диполями растворителя возникают и другие типы ион-дипольного взаимодействия, имеющие более сложную природу. Совокупность таких взаимодействий (наиболее типичными из которых являются водородные связи), а также существенных для некоторых систем диполь-дипольных взаимодействий часто описывают в терминах донорно-акцепторных свойств растворителей. Состояние ионов в растворах В результате процесса сольватации в растворе должны присутствовать не свободные ионы, а ионы с сольватной оболочкой. Данные по энтропии сольватации, по уменьшению диэлектрической проницаемости и объема растворителя в присутствии ионов, по снижению времени релаксации, по подвижности ионов в электрическом поле указывают на то, что часть молекул растворителя довольно прочно связана с ионами. Это предположение находит прямое подтверждение в различных структурных исследованиях растворов. Бокрис и Конвей различают первичную и вторичную сольватные оболочки. Количество молекул растворителя, входящих во внутреннюю сольватную оболочку, называется числом сольватации n s (числом гидратации n г). Различные методы определения чисел сольватации приводят к значениям, существенно отличающимся друг от друга. В методе Улиха предполагается, что образование внутреннего гидратного слоя подобно замерзанию воды. Такое представление разделяют и многие другие авторы: Эли и Эванс сравнивают сольватный слой с микроскопическим айсбергом, сформировавшимся вокруг частицы растворенного вещества. Так как уменьшение энтропии при замерзании воды составляет 25,08 Дж/(К×моль), число гидратации можно оценить из соотношения: n г = – DSог / 25,08 = – 0,04 DSог . Другой метод основан на изменении диэлектрической проницаемости раствора с концентрацией электролита. Число гидратации можно также получить, измеряя сжимаемость воды и раствора. Несмотря на значительное расхождение между результатами различных методов, все они приводят к заключению об увеличении числа гидратации с уменьшением радиуса ионов и с ростом их заряда. Например, в ряду щелочных металлов эффективный радиус катиона уменьшается от лития к цезию. Предельное значение числа сольватации определяется координационным числом КЧ сольватируемого иона, то есть числом кратчайших эквивалентных связей, образуемых с молекулами растворителя без стерических затруднений. Подавляющее число катионов образует октаэдрические комплексы (КЧ = 6); для катионов малого размера КЧ = 4 (тетраэдрическое окружение); ионы сложного строения (лантаниды и актиниды) характеризуются КЧ до 12. Детальную информацию о КЧ предоставляют дифрактометрические методы. Числа сольватации не всегда совпадают с КЧ. Кроме того, наблюдается эффективное снижение чисел сольватации с ростом концентрации. Особыми закономерностями сольватации в протонных средах (в частности, в воде) характеризуются ионы гидроксония и гидроксила благодаря их способности образовывать водородные связи с растворителем, по прочности не уступающие связям между молекулами воды.
Лекция 2
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 703; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.01 с.) |

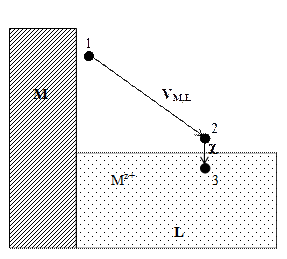 Рис. 3. Схема для расчета реальной энергии сольватации иона
Рис. 3. Схема для расчета реальной энергии сольватации иона
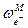 , где
, где 


