
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние природы растворителя на электропроводностьСодержание книги
Поиск на нашем сайте
Электропроводность растворов электролитов зависит в первую очередь от природы электролита и растворителя. При переходе от воды к другим растворителям изменяются величина электропроводности и, в меньшей степени, число переноса. Основными свойствами растворителя, обусловливающими характер изменения электропроводности, являются его вязкость и диэлектрическая проницаемость. Повышение вязкости снижает электропроводность. Количественное выражение этого эффекта дается правилом Вальдена – Писаржевского: lоhо = const (lо – электропроводность электролита, экстраполированная до нулевой концентрации; hо – вязкость чистого растворителя). Правило Вальдена – Писаржевского приближенно и оправдывается лишь для растворителей с близкими величинами диэлектрических проницаемостей. Правило хорошо соблюдается для больших органических ионов (например, [(C3H7)4N]+), а также для некоторых обычных ионов, но в узком интервале температур. Причины, по которым правило носит приближенный характер, будут рассмотрены ниже, при обсуждении вопросов теоретической интерпретации электропроводности электролитов. Величина диэлектрической проницаемости растворителя влияет особенно заметно на характер изменения электропроводности с концентрацией. Подвижность ионов Свяжем электропроводность электролита со скоростью движения его ионов в электрическом поле. По закону Ома R = U/I. Следовательно, K = I/U; I = i × S (i - плотность тока, или ток, приходящийся на 1 см2 поверхности электрода; S - площадь электрода); U = E × l (Е - напряженность поля, или падение напряжения на 1 см расстояния; l - расстояние между электродами). Тогда k При Е = 1 В/см i = k. I = Таким образом, k - это количество электричества, которое проходит в единицу времени через единицу поперечного сечения проводника при напряженности электрического поля 1 В/см. Следовательно, для вычисления электропроводности надо подсчитать число ионов, проходящих через поперечное сечение электролитического сосуда в единицу времени. Так как электричество переносится ионами различных знаков, движущимися в противоположных направлениях, то общая сила тока складывается из количеств электричества, перенесенных катионами (I+) и анионами (I–): I = I+ + I–. Введем обозначения: u¢ - скорость движения катионов (см/с); v¢ - скорость движения анионов (см/с); с ¢ - эквивалентная концентрация (г-экв/см3); S - поперечное сечение цилиндрического сосуда (см2); l - расстояние между электродами (см); U - разность потенциалов между электродами (В). Подсчитаем количество катионов, проходящих через поперечное сечение электролита в 1 секунду. За это время через сечение пройдут все катионы, находившиеся на расстоянии не более чем u¢ см от выбранного сечения, то есть все катионы в объеме u¢S: n + = u¢S c +. Так как каждый г-экв ионов несет согласно закону Фарадея F =96485 Кл электричества, то сила тока (в А) I+ = n + F = u¢S c + F. Аналогично для анионов I– = n – F = v¢S c – F. Для суммарной силы тока (предполагая, что электролит бинарный и полностью диссоциированный, так что с + = с – = с ¢): I = I+ + I– = (u¢ + v¢)S c ¢F. Скорости движения ионов u¢ и v¢ зависят от природы ионов, напряженности электрического поля U/ l, концентрации, температуры, вязкости среды и т.п. Пусть все факторы постоянны, кроме напряженности электрического поля; можно считать, что скорость ионов пропорциональна приложенной силе, то есть напряженности поля: u¢ = u где u, v - скорости ионов в стандартных условиях, то есть при напряженности поля, равной 1 В/см; они называются абсолютными подвижностями ионов и измеряются в см2/(с×В). I = (u + v) c ¢SFU/ l. По закону Ома I = U/R = U×K = U×k Отсюда k = (u + v) c ¢F, l = u×F и v×F - это скорости движения ионов, выраженные в электростатических единицах; они называются ионными электропроводностями (или просто подвижностями ионов): u×F = l+, v×F = l–. Для сильных электролитов l = l+ + l–. Для слабых электролитов с + = с ×a, с – = с ×a, l = (l+ + l–)×a. При бесконечном разведении (j ® ¥, a ® 1, с + = с – = с): l¥ = lо+ + lо– - как для сильных, так и для слабых электролитов. Величины lо+ и lо– являются предельными электропроводностями (предельными подвижностями) ионов. Они равны эквивалентным электропроводностям катиона и аниона при бесконечном разведении и измеряются в тех же единицах, что и l и l¥, то есть в см2/(Ом×г-экв). Вышеприведенное уравнение является выражением закона Кольрауша: эквивалентная электропроводность при бесконечном разведении равна сумме предельных подвижностей ионов. Таким образом, для всех электролитов можно записать lс = aс ×l¥, aс = lс / l¥. l+ и l– зависят от концентрации (разведения), особенно для сильных электролитов; lо+ и lо– - табличные величины. Все эти величины относятся к 1 г-экв ионов. Подвижность является важнейшей характеристикой ионов, отражающей их специфическое участие в электропроводности электролита. В водных растворах все ионы, за исключением ионов Н3О+ и ОН–, обладают подвижностями одного порядка; их lо составляют не более 80 см2/(Ом×г-экв) при 25оС; их абсолютные подвижности (u и v) равны нескольким см в час. Подвижности же ионов Н3О+ и ОН– составляют соответственно ~350 и ~200 см2/(Ом×г-экв). В результате эквивалентная электропроводность растворов солей выражается величинами порядка 100 – 130 см2/(г-экв×Ом). Ввиду исключительной подвижности иона гидроксония величины l¥ для кислот в 3-4 раза больше, чем для солей; щелочи занимают промежуточное положение. Рассмотрим влияние природы иона (его радиуса и заряда) на величину подвижности иона. Движение иона можно уподобить движению макроскопического шарика в вязкой среде и применить в этом случае формулу Стокса u¢ = где е - заряд электрона; z - число элементарных зарядов иона; r - эффективный радиус иона; h - коэффициент вязкости; U/ l - напряженность поля. Движущую силу - напряженность поля U/ l при вычислении абсолютных подвижностей принимаем равной единице. Следовательно, скорость движения ионов обратно пропорциональна их радиусу. Рассмотрим ряд Li+, Na+, K+ , Rb+ , Cs+ . Так как в указанном ряду истинные радиусы ионов увеличиваются, то подвижности должны уменьшаться в той же последовательности. Однако в действительности это не так. Подвижности увеличиваются при переходе от Li+ к K+ почти в два раза. Из этого можно сделать заключение, что в растворе и ионной решётке ионы обладают разными радиусами. При этом чем меньше истинный (кристаллохимический) радиус иона, тем больше его эффективный радиус в электролите. Это явление можно объяснить тем, что в растворе ионы не свободны, а гидратированы. Тогда эффективный радиус движущегося в электрическом поле иона будет определяться в основном степенью его гидратации, то есть количеством связанных с ионом молекул воды. Связь иона с молекулами растворителя ионно-дипольная, а так как напряжённость поля на поверхности иона лития гораздо больше, чем на поверхности иона калия, то степень гидратации иона лития больше степени гидратации иона калия. Таким образом, при переходе от катиона Li+ к катиону Rb + подвижность не падает, а возрастает, так как радиус гидратированного иона Li+ больше, чем радиус гидратированного иона Na+ и т.д. Однако если собственный размер иона возрастает настолько, что прочная гидратная оболочка вокруг него уже не удерживается, то при дальнейшем увеличении кристаллографического радиуса следует ожидать уменьшения подвижности. Эта закономерность наблюдается и для катионов (при переходе от Cs + к [(CH3)4N]+ ), и для анионов (при переходе от Br– к J– и далее к CH3COO– ). В ряду катионов и анионов размеры ионов Rb + , Cs + и Br– , J– являются как бы критическими: при меньших собственных размерах ионов они образуют прочную гидратную оболочку и их окончательный размер становится больше, а l i o – меньше; с другой стороны, при бόльших собственных размерах ионов они гидратированы, и l i o падает из-за увеличения собственного радиуса иона. Итак, ионы Rb + , Cs + , Br– , J– обладают наибольшей подвижностью из всех ионов, за исключением Н3О+ и ОН– . Согласно формуле Стокса многозарядные ионы должны обладать большей подвижностью, чем однозарядные. Однако скорости движения многозарядных ионов ненамного превышают скорости движения однозарядных, что объясняется большей степенью их гидратации.
|
||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 814; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |


 =
= 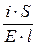 ; i = k× E.
; i = k× E.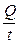 ; i =
; i =  .
.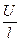 , v¢ = v
, v¢ = v  .
. ; с ¢ = с /1000; l = k/ с ¢ = (u + v)F.
; с ¢ = с /1000; l = k/ с ¢ = (u + v)F.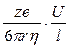 ,
,


