
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Удельная и эквивалентная электропроводностьСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электропроводность К - величина, обратная электрическому сопротивлению R. Так как R = r где r - удельное электрическое сопротивление; l - расстояние между электродами; S - площадь электрода; k - удельная электропроводность. Удельная электропроводность k жидкости - это электропроводность одного кубического сантиметра раствора, заполняющего пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Кубический сантиметр раствора должен находиться вдали от границ электрода. [k] = Ом–1× см–1. Требования к электродам (плоские, параллельно расположенные) вытекают из необходимости создания однородного электрического поля. Кривая зависимости удельной электропроводности растворов от концентрации обычно имеет максимум (четко выраженный для сильных электролитов и сглаженный для слабых), как показано на рис. 5. Наличие максимумов на кривых k - с можно объяснить следующим образом. Электропроводность растет пропорционально числу ионов, которое, в свою очередь, растет с концентрацией, но существуют и факторы противоположного действия. В концентрированных растворах сильных электролитов ионная атмосфера существенно уменьшает скорость движения ионов, и электропроводность падает. В слабых электролитах плотность ионной атмосферы мала и скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора заметно уменьшается степень диссоциации, что приводит к уменьшению концентрации ионов и падению электропроводности.
Удельная электропроводность зависит от температуры. Зависимость дается эмпирическим уравнением kt = k25 × [1 + a (t – 25) + b (t – 25)2], где a, b - температурные коэффициент электропроводности; k25 (k18) - стандартное значение. Коэффициент a зависит от природы электролита; он равен для сильных кислот 0,0164, для сильных щелочей 0,0190, для солей 0,0220. В случае слабых электролитов a больше, чем для сильных. Коэффициент b увеличивается закономерно с ростом a; их связь передается эмпирическим уравнением
b = 0,0163 (a – 0,0174). Следует отметить, что температурные коэффициенты электропроводности водных растворов и вязкости воды близки по своей величине, но обратны по знаку. Это свидетельствует о том, что увеличение удельной электропроводности с ростом температуры связано, главным образом, с уменьшением вязкости раствора. Эквивалентная электропроводность l [в см2/(г-экв×Ом)] - это электропроводность такого объема (j см3) раствора, в котором содержится 1 г-экв растворенного вещества; раствор заполняет пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Найдем связь между k и l. Представим себе погруженные в раствор параллельные электроды на расстоянии 1 см, имеющие весьма большую площадь. Электропроводность раствора, заключенного между поверхностями таких электродов, имеющими площадь, равную j см2, и есть эквивалентная электропроводность раствора. Объем раствора между этими площадями электродов равен j см3 и содержит 1 г-экв соли. Величина j, равная 1000/ с см3/г-экв, называется разведением. Таким образом, l = k× j; l = Зависимость эквивалентной электропроводности от концентрации: 1. Зависимость l - с: с увеличением с величина l уменьшается сначала резко, а затем более плавно (см. рис. 6). 2. Зависимость l - l = l¥ - А l¥ - предельная эквивалентная электропроводность при бесконечном разведении (с ® 0, j ® ¥); А – эмпирическая постоянная. При несколько более высоких концентрациях сильных электролитов лучшее согласие с опытом дает уравнение, известное под названием закона кубического корня: l = l¥ - А Для разбавленных растворов слабых электролитов справедливо уравнение lg l = const – 3. Зависимость l - j: значение l сильных электролитов растет с увеличением j и асимптотически приближается к l¥. Для слабых электролитов значение l также растет с увеличением j, но приближение к пределу и величину предела в большинстве случаев практически нельзя установить (рис 7, б).
Мольная электропроводность электролита m - это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества. Все вышесказанное касалось электропроводности водных растворов. Для электролитов с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например, на кривых l - с часто наблюдается минимум (аномальная электропроводность).
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1491; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.176.136 (0.007 с.) |

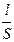 , то К =
, то К = 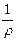 ×
×  = k
= k  k сильный электролит
слабый электролит
с
Рис. 5. Зависимость удельной электропроводности от концентрации электролита
k сильный электролит
слабый электролит
с
Рис. 5. Зависимость удельной электропроводности от концентрации электролита
 l
сильный электролит
слабый электролит
с
Рис. 6. Зависимость эквивалентной электропроводности от концентрации электролита
l
сильный электролит
слабый электролит
с
Рис. 6. Зависимость эквивалентной электропроводности от концентрации электролита
 .
.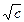 : для сильных электролитов в области малых концентраций соблюдается медленное линейное уменьшение l с увеличением
: для сильных электролитов в области малых концентраций соблюдается медленное линейное уменьшение l с увеличением 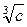 .
.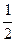 lg c.
lg c. l
сильный электролит
слабый электролит
l
сильный электролит
слабый электролит
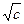
 l
l¥
сильный электролит
слабый электролит
j
l
l¥
сильный электролит
слабый электролит
j



