Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость электропроводности от концентрации электролита.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
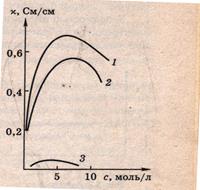
В разбавленных растворах удельная электропроводность с увеличением концентрации растет, при некоторой достаточно высокой концентрации достигает максимума и затем уменьшается. На рис. 2.1. приведены типичные примеры этой зависимости. Электрическая проводимость слабого электролита CH3COOH значительно ниже соответствующей величины для растворов сильных электролитов HCl и КОН. Возрастание электропроводности с ростом концентрации в растворах умеренно высокой концентрации происходит вследствие увеличения числа ионов. Однако в концентрированных растворах возникают и другие эффекты, приводящие уже к уменьшению электропроводности.
Рис.2.1. Электрическая проводимость: 1- HCl; 2 – KOH; 3 - CH3COOH
В концентрированных растворах возникают силы межионного взаимодействия, вследствие чего происходит образование межионных ассоциатов или ионных пар, увеличивается вязкость раствора и проявляются другие эффекты, снижающие скорость движения ионов и вызывающие уменьшение электрической проводимости. Как суммарный результат действия этих факторов на кривой проводимости возникает максимум. Для аналитических измерений обычно используется участок кривой с возрастающей удельной электропроводностью, т.е. область разбавленных и умеренно концентрированных растворов. Поскольку электропроводнсть электролитов зависит от концентрации последних, в электрохимии часто используют такие величины, как молярная и эквивалентная электропроводности. Эквивалентной электропроводностью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Единицы измерения - См∙см2/моль-экв. Удельная и эквивалентная электропроводности связаны между собой: λ = 1000æ/с, (2.2) где λ – эквивалентная электропроводность, с – молярная концентрация эквивалента. Молярная и эквивалентная электропроводности определяются величинами подвижностей ионов. Подвижность является характеристикой движения ионов в электрическом поле. Не зависящей от напряженности поля: u = v/E, (2.3) где u- подвижность иона, v – скорость движения иона в электрическом поле, E – напряженность электрического поля. Связь между эквивалентной электропроводностью и подвижностями ионов (u + - подвижность катионов, u - - подвижность анионов) следующая: λ = F(u+ + u-) = λ+ + λ- (2.4) Это уравнение отражает закон независимого движения ионов – закон Кольрауша: в растворе электролита катионы и анионы проводят электрический ток независимо друг от друга. Электропроводность определяется также степенью диссоциации электролита. Для сильных и слабых электролитов зависимость электропроводности от концентрации различна. У полностью диссоциированных сильных электролитов в области разбавленных растворов (0.001 М и меньше) концентрационная зависимость электропроводности выражается уравнением: λ = λ0 -а√с, (2.5) где λ0 – предельная эквивалентная электропроводность сильного электролита при бесконечном разбавлении, а – константа. Числовые значения подвижностей ионов в водном растворе при комнатной температуре находятся в пределах 30 -70 См∙см2/моль-экв. Лишь у ионов Н+ и ОН- они существенно выше: λ0 (Н+) = 350, λ0 (ОН-) = 199 См∙см2/моль-экв, что связано с особым эстафетным механизмом перемещения этих ионов в электрическом поле. Для слабых электролитов концентрационная зависимость электропроводности имеет более сложный характер. Это объясняется тем, что на λ в этом случае влияет еще и увеличение степени диссоциации электролита с разбавлением раствора, вызывающее более быстрое, чем у сильных электролитов, увеличение электропроводности. Обычно электропроводность раствора определяют с помощью моста переменного тока. Постоянный ток нежелателен, так как вызывает электролиз раствора, что в свою очередь ведет к возникновению градиента химического потенциала (изменению количества ионов). при наложении на раствор переменной разности потенциалов ионы колеблются около некоторого среднего положения и grad μ = 0. Конструкции измерительных электрохимических ячеек весьма разнообразны. В прямой кондуктометрии обычно используют ячейки с жестко закрепленными в них электродами. В методах кондуктометрического титрования – ячейки с погруженными электродами, позволяющие проводить титрование в любых сосудах, в которых можно разместить электроды. Электроды, используемые в кондуктометрии, изготавливают из платины, серебра или нержавеющей стали. Экспериментально измеряемая величина сопротивления раствора зависит не только от размера электродов и расстояния между ними, но и от их формы и взаимного расположения, объема раствора и других факторов, не всегда поддающихся точному учету, так как токопроводящим является не только тот объем раствора, который заключен между электродами. Действительная электрическая проводимость раствора, конечно, не зависит от этих факторов. А определяется лишь концентрацией раствора, природой электролит и температурой. Истинная электрическая проводимость пропорциональна экспериментально измеренной величине проводимости: æ = kæI, (2.6) где k – константа ячейки. Константу ячейки находят экспериментально по электрической проводимости стандартных растворов с хорошо известным электропроводности в широкой области температур и концентраций. Обычно используют растворы хлорида калия.
Прямая кондуктометрия. Методы прямой кондуктометрии основаны на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита. В практической работе обычно используют заранее построенную градуировочную кривую зависимости электропроводности от концентрации тех или иных электролитов. В связи с относительно близкими значениями подвижностей ионов кондуктометрические измерения дают информацию, главным образом, лишь об общей концентрации ионов в растворе. Малая селективность кондуктометрических методов является одним из его существенных недостатков.
2.3. Кондуктометрическое титрование.
В методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах æ –V(титранта). Практически в этом методе могут быть использованы такие химические реакции, в ходе которых достаточно заметно изменяется электропроводность раствора или происходит резкое изменение электропроводности после точки эквивалентности.
2.3.1. Реакции кислотно-основного взаимодействия.
При титровании сильной кислоты сильным основанием до ТЭ наблюдается резкое уменьшение электрической проводимости, связанное с уменьшением в растворе концентрации иона Н+. После ТЭ начинается резкий подъем электропроводности, так как будет расти концентрация ионов ОН-. (Рис. 2.2). Точка эквивалентности в кондуктометрическом титровании находится путем графического построения. Как видно из рис. 2.2 экспериментальные значения электрической проводимости раствора вблизи ТЭ особого значения не имеют. Для построения используются области недотитрованных и перетитрованных растворов. В некоторых случаях, например при титровании очень разбавленных растворов, обе ветви кривой титровния сглаживаются, и ТЭ может быть определена только с помощью экстраполяции прямолинейных участков кривой.
Рис. 2.2. Кривая кондуктометрического титрования сильной кислоты сильным основанием.
На рис. 2.3 представлена кривая титрования слабой кислоты сильным основанием. Удельная электрическая проводимость раствора до ТЭ несколько возрастает, так как при титровании происходит увеличение концентрации соли. Концентрация ионов Н+ в растворе слабой кислоты и ее соли, получившейся при титровании, невилика и уменьшение [Н+] в ходе титрования не вызывает столь резкого падения электропроводности. Какое наблюдалось при титровании сильной кислоты
Рис. 2.3. Кривая кондуктометрического титрования слабой кислоты сильным основанием.
Рис.2.4. Кривая кондуктометрического титрования смеси сильной м слабой кислот. На рис.2.4 приведена кривая титрования смеси сильной и слабой кислот. Кривая имеет два излома, соответствующие двум точкам эквивалентности: первая показывает объем щелочи, пошедшей на титрование сильной кислоты, а вторая дает объем щелочи, израсходованный га титрование обеих кислот. С увеличением константы диссоциации слабой кислоты первый излом будет становиться менее резким, а второй – более четким, и, наоборот, чем слабее кислота, тем резче будет первый излом, и более закругленным второй.
Реакции осаждения. Вид кривой кондуктометрического титрования по методу осаждения зависит от концентрации и подвижности ионов и растворимости образующегося соединения. Чем меньше ПР продукта реакции, тем резче выражен излом кривоититрования в ТЭ. Результаты анализа 0.1 М растворов бывают вполне удовлетворительными, если у бинарно госоединения ПР ≤ 10-5. У более растворимых соединений точка эквивалентности устанавливается с трудом, так как кривая титрования плавно закругляется. Излом на кривой титрования становится менее четким также с уменьшением концентрации раствора, и, например, при анализе 10-3 М растворов ПР продукта реакции должно быть уже не больше чем 10-9. Введение в анализируемый водный раствор органического растворителя понижает растворимость, поэтому излом на кривой титрования становится более резким. Влияние подвижности ионов проявляется в наклоне кривой титрования до точки эквивалентности. После точки эквивалентности проводимость во всех случаях будет расти, так как увеличивается концентрация ионов в растворе. Титрование, например, нитрата бария сульфатом натрия происходит по уравнению реакции Ba(NO3)2 + Na2SO4 = Ba SO4↓ + 2NaNO3 До ТЭ электропроводность раствора будет несколько падать, так как вместо Ba(NO3)2 (λ0 (Ba2+) = 63.6) в растворе появляется эквивалентное количество NaNO3 (λ0 (Na+) = 50.1), т.е. в растворе появляются ионы с меньшей величиной подвижности. Первая же капля раствора сульфата натрия вызовет после ТЭ вызовет резкое увеличение электропроводности благодаря возрастанию концентрации электролита в растворе.
2.3.3. Реакции комплексообразования. Для кондуктометрического титрования катионов в качестве титрантов могут быть использованы растворы различных кислот и оксикислот (щавелевой, винной, лимонной и др.), комплексонов и других лигандов. Наибольшее практическое значение имеет кондуктометрическое титрование катионов металлов двузамещенной солью этилендиаминтетрауксусной кислоты (ЭДТА).
Рис. 2.5. Кривая кондуктометрического титрования Fe3+ раствором ЭДТА.
При титровании, например, Fe3+ раствором ЭДТА (Y4-) протекает реакция Fe3+ + H2Y2- = FeY- + 2Н+ В результате которой выделяются ионы Н+ и растет электрическая проводимость раствора. После точки эквивалентности электропроводность падает, так как выделившиеся ионы Н+ связываются анионом H2Y2- Н+ + H2Y2- = H3Y- Кривая титрования представлена на рис. 2.5. Несколько иной вид имеет кривая титрования катиона в буферном растворе, аналогичный с кривой титрования. изображенной на рис. 2.3. Выделяющиеся ионы водорода в этом случае взаимодействуют с протоноакцепторным компонентом буферной системы и не дают поэтому столь заметного вклада в электрическую проводимость раствора. До ТЭ электрическая проводимость раствора несколько увеличивается, что связано связано с увеличением концентрации ионов натрия, вводимых с титрантом, а после ТЭ резко возрастает, так как увеличивается концентрация титранта.
Лабораторные работы.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 7970; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.221.114 (0.007 с.) |