
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Металлов (кобальта, железа, никеля).Содержание книги
Поиск на нашем сайте
Определение солей металлов основано на реакции комплексообразования этилендиаминтетраацетатом натрия (ЭДТА): Mn+ + H2Y2- ↔ MY n-4 + 2H+ До достижения точки электрическая проводимость возрастает вследствие накопления ионов водорода. При появлении в растворе избытка титранта электрическая проводимость или остается практически постоянной, или понижается вследствие связывания накопившихся ионов водорода избытком ЭДТА. В ряде случаев можно проводить определение двух компонентов, одновременно находящихся в растворе. Условием успешности такого определения является существенное различие в константах устойчивости комплексов определяемых металлов с ЭДТА. Например, комплексонат железа FeY- значительно прочнее, чем комплексонат никеля NiY2- и комплексонат кобальта СоY2- . Это позволяет раздельно определятьсодержание железа и никеля (или железа и кобальта) в смеси. В первую очередь оттитровывается железо, а затем – никель (или кобальт). В сооветствии с эти мна кривой титрования появляются два излома: объем V1 соответствует оттировыванию железа, объем V2 –сумме двух катионов.
Реактивы и аппаратура. Сульфат цинка ZnSO4∙7H2O, 0.01М титрованный раствор. ЭДТА Na2H2C10 H12N2O8∙2 H2O (Na2H2Y), 0.01 М раствор. Установка для кондуктометрического титрования в комплекте с кондуктометром.
Выполнение работы. 1. Подготовка прибора к работе. См п.1 в работе 2.4.1. 2. Стандартизация раствора ЭДТА. Конценрацию ЭДТА устанавливают по титрованному раствору сульфата цинка. Для титрования в ячейку помещают 10 мл титрованного раствора сульфата цинка. Порциями по 0.5 мл приливают из бюретки раствор титранта и снимают показания прибора. Титрование продолжают до тех пор, пока не обнаружат излом на кривой титрования. После этого приливают еще 4 -5 порций титранта и титрование заканчивают. По полученным данным строят кривую титрования, находят ТЭ и рассчитывают молярную концентрацию ЭДТА. 3. Анализ исследуемого раствора. Исследуемый раствор может содержать либо индивидуальное соединение – соль кальция, железа, никеля, кобальта, либо смесь двух компонентов – соли железа и никеля, соли железа и кобальта. Анализируемый раствор помещают в мерную колбу (50-100 мл) и доводят до метки водой. Аликвоту (5-10 мл) полученного раствора переносят в ячейку для титрования. Добавляют воду до нужного уровня и выполняют титрование. Титрование продолжают до тех пор, пока по показаниям прибора не обнаружат один или два излома на кривой - в зависимости от числа определяемых компонентов. Строят кривые титрования, определяют точки эквивалентности и рассчитывают массу определяемых элементов в растворе.
2.4.4 Определение констант диссоциации фосфорной кислоты методом прямой кондуктометрии.
Слабая кислота в разбавленном растворе диссоциирует по схеме: HR↔H+ + R-. Степень ее диссоциации α может быть найдена по эквивалентной электрической проводимости λ растворов кислоты с разной концентрацией: α = [H+]/C HR = λ/ λ0, (2.7) где λ – экспериментальное значение эквивалентной электрической проводимости; λ0 – эквивалентная электрическая проводимость при бесконечном разбавлении, рассчитываемая по табличным данным как сумма подвижностей ионов. Константа диссоциации кислоты рассчитывается по уравнению:
Если табличные данные по подвижностям ионов отсутствуют, величины КHR и λ0 можно найти из экспериментальных данных по электрической проводимости исследуемых растворов при нескольких концентрациях. Для этого необходимо придать уравнению () вид: КHR λ02- КHR λ0 λ0 = λ2 СHR’ (2.9) Если обе части уравнения () поделить на КHR λ02 λ, то получим:
График, построенный в координатах 1 /λ - λ СHR, будет представлять собой прямую линию с угловым коэффициентом 1/(КHR λ02), отсекающая на ординате отрезок 1/ λ0.
Реактивы и аппаратура. Фосфорная кислота H3PO4, 0.1 М раствор. Соляная кислота HCl, 0.100 М раствор. Гидроксид натрия NaOH, 0.1 М раствор. Кондуктометр. Установка для кондуктометрического титрования.
Выполнение работы. 1. Уточнение концентрации фосфорной кислоты. Для этого необходимо сначала стандартизовать раствор гидроксида натрия по соляной кислоте (См. п. 2 в 2.4.1). После чего проводят уточнение концентрации H3PO4. Для этого аликвоту кислоты 10 мл помещают в ячейку для титрования, добавляют необходимое количество воды и титруют 0.100 М раствором гидроксида натрия. Определяют графически ТЭ и рассчитывают концентрацию фосфорной кислоты.
2. Определение константы кондуктометрической ячейки. Растворением навески хлорида калия в дистиллированной воде готовят раствор, концентрация которого 0.1 М. Путем разбавления этого раствора в мерных колбах (50 мл) готовят стандартные растворы хлорида калия 0.02 и 0.01 М. Колбы с раствором выдерживают в течение 20-25 мин в термостате при температуре 25 °С. Кондуктометрическую ячейку тщательно промывают дистиллированной водой, ополаскивают стандартным раствором КСl 0.01 М, после чего помещают в термостат и наливают такое количество раствора, чтобы электроды были погружены в раствор. Следует помнить, что при всех измерениях в методе прямой кондуктометрии объем раствора должен быть одним и тем же. (Для этого пользоваться пипеткой на 25 -50 мл). Измеряют электропроводность æI, по таблицам находят истинное значение æ для раствора хлорида калия и по формуле æ = kæI рассчитывают константу ячейки. Для второго стандартного раствора КСl проводят те же операции. Определяют среднее значение константы ячейки. 3. Определение первой константы диссоциации К1. Готовят серию из 6 растворов фосфорной кислоты в колбах на 100 мл с концентрациями 10-1 -10-6 М методом последовательного разбавления. В приготовленных растворах измеряют электропроводность, предварительно выдержав растворы в термостате при 25 °С в течение 20-25 мин. Из полученных результатов рассчитывают удельную электропроводность, а из нее – эквивалентную электропроводность. Необходимо также измерить электропроводность дистиллированной воды в стандартных условиях и учитывать ее при расчете эквивалентной электропроводности очень разбавленных растворов. По полученным данным строят градуировочный график в координатах 1 /λ = f (λ С H3PO4). С помощью графика определяют λ0, а затем и К1. 4. Определение второй константы диссоциации фосфорной кислоты К2. Готовят серию растворов NaOH с точной концентрацией 10-1 -10-6 М методом последовательного разбавления исходного стандартизованного 10-1 М раствора. В шесть стаканчиков помещают по 20 мл фосфорной кислоты соответствующей концентрации (10-1, 10-2 , 10-3 , 10-4 , 10-5 , 10-6М). Соответствующим раствором щелочи нейтрализуют катионы водорода, соответствующие первой ступени диссоциации. Количество необходимой щелочи рассчитывают в соответствии с законом эквивалентов. В результате проделанных операций получают шесть растворов разной концентрации кислоты H2PO4-. Концентрации H2PO4- рассчитывают по формуле: [H2PO4-]=C(а2) где С(а1) – эквивалентная концентрация кислоты H3PO4, C(а2)- эквивалентная концентрация кислоты H2PO4-. Таким образом, получают серию растворов кислоты H2PO4- с концентрациями С(а1) - С(а6). В кондуктометрическую ячейку помещают термостатированные при 25 °С полученные растворы в строго фиксированном объеме (объем такой же как и в предыдущих опытах) и измеряют их электропроводность. Измерения надо начинать с самых разбавленных растворов. Кондуктометрическую ячейку и электроды необходимо тщательно промывать, как это описано выше. По данным электропроводности строят графическую зависимость 1 /λ = f (λ С H2PO4-). С помощью графика определяют λ0, а затем и К2.. 5. Определение третьей константы диссоциации фосфорной кислоты К3. Аналогичным образом (по п.4) готовят серию растворов кислоты HPO42-. Определяют их электропроводность, строят графическую зависимость 1 /λ = f (λ С HPO42-). С помощью графика определяют λ0, а затем и К3
6. Полученные значения констант сравнивают с табличными и рассчитываю относительную ошибку определения. Табличные значения констант: К1 = 7.1∙10-3, К2 = 6.2∙10-8, К3 = 5.0∙10-13.
2.5. Контрольные вопросы.
1. В чем сущность кондуктометрических методов анализа? 2. Какие величины входят в уравнение закона Кольрауша? 3. Как влияет на электрическую проводимость: а) природа электролита и растворителя; б) концентрация электролита (сильного, слабого); в) температура? 4. Какая величина называется удельной электрической проводимостью? 5. В чем состоит сущность закона независимого движения ионов? 6. Как можно кондуктометрически определить константу диссоциации слабой кислоты? 7. Какие определения невозможно выполнить методом пря- мой кондуктометрии: а) определение качества дистилли- рованной воды; б) содержание натрия и калия в морской воде; в) общее содержание примесей в технической сер- ной кислоте; г) общее содержание солей в минеральных водах? 8. Какой вид имеет кривая титрования слабой кислоты силь- ным основанием? 9. Какой вид имеет кривая титрования сильного основания сильной кислотой? 10. Всегда ли приливание избытка титранта вызывает рост электрической проводимости? Какой пример это опро- ввергает?
|
|||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.74.120 (0.01 с.) |

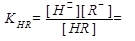

 (2.8)
(2.8)

 (2.10)
(2.10) , (2.11)
, (2.11)


