
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хлорсерябряный электрод – электрод сравнения.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электроды сравнения должны обладать устойчивым во времени воспроизводимым потенциалом, не меняющемся при прохождении небольшого тока. Чаще всего в качестве электродов сравнения применяют электроды второго рода: хлорсеребряный и каломельный. Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую слоем AgCl и помещенную в раствор KCl (3М). Активность ионов серебра в таком растворе равна:
Подставляя эту величину в уравнение Нернста для серебряного электрода получают выражение для потенциала хлорсеребряного электрода:
Прямая потенциометрия Методы прямой потенциометрии (ионометрии) основаны на непосредственном применении уравнения Нернста для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи или потенциалу электрода. Измерение рН с помощью стеклянного электрода. Едва ли не самое известное применение прямой потенциометрии состоит из измерения рН при помощи стеклянного электрода. Стеклянный электрод (рис.1) представляет собой тонкостенный стеклянный шарик 1, заполненный раствором HCl или каким-либо буферным раствором 2. Внутрь шарика помещают хлорсеребряный электрод 3. Это устройство обычно закрывают защитной трубкой 4. При контакте с раствором приповерхностный слой стекла выступает в роли ионообменника, обменивая катионы, находящиеся в пустотах силикатного каркаса, на катионы водорода. Для того чтобы мембрана электрода приобрела такую способность, ее следует предварительно вымочить в кислом растворе.
Рис.1. Стеклянный электрод.
Равновесное значение потенциала стеклянного электрода зависит от активности ионов Н+ в анализируемом растворе (а 1) и внутреннем растворе электрода (а 2). В первом приближении эта зависимость имеет вид:
Поскольку активность ионов Н+ во внутреннем растворе постоянна, то
Подставляя численные значения параметров и переходя от логарифмов к десятичным. При 25°С имеем:
Величина Еconst зависит от значения рН внутреннего раствора, а также от потенциала асимметрии стеклянной мембраны, представляющий собой разность потенциалов между двумя сторонами стеклянной мембраны. Она возникает из-за несовпадения свойств разных сторон мембраны и может быть измерена экспериментально. Если по обе стороны мембраны поместить один и тот же раствор. Еconst зависит также от константы равновесия Н+ (р-р)↔ Н+ (стекло), характеризующей сорт стекла и некоторые другие свойства стеклянного электрода. Стандартный потенциал стеклянного электрода обычно не определяют. При использовании заводских рН-метров эта операция заменяется настройкой приборов по стандартным буферным растворам. В настоящее время сконструированы стеклянные ионселективные электроды, чувствительные к ионам щелочных металлов Li+, Na+, K+, Rb+, Cs+, а также к ионам Ag+, Tl+, NH4+. Их устройство и принцип действия такие же, как и стеклянного рН-электрода.
Ионселективные электроды.
Стеклянный электрод для измерения рН является примером широкого класса электродов, называемых ионселективными. Многие ИСЭ, применяемые для определения различных ионов, устроены совершенно аналогично стеклянному. ИСЭ классифицируются по типу мембраны и различаются твердые ИСЭ и жидкостные ИСЭ. Твердые ИСЭ в свою очередь подразделяются на электроды с монокристаллическими и поликристаллическими мембранами. В ИСЭ с монокристаллической мембраной ионочувствительный элемент изготавливается из малорастворимого кристаллического вещества с ионным характером проводимости. Перенос заряда в таком кристалле происходит за счет дефектов кристаллической решетки. Вакансии могут заниматься только ионом определенного размера и заряда, что обуславливает высокую селективность монокристаллических мембран. Конструктивно такие электроды сходны со стеклянными: в обоих Селективность электродах мембраны разделяют исследуемый раствор и раствор сравнения, в котором находится внутренний электрод сравнения (обычно хлорсеребряный). Из электродов этого типа широко применяется фторидный электрод, в котором мембраной является LaF3, имеющий чисто фторидную проводимость. ИСЭ с поликристаллическими мембранами обладают недостаточно устойчивым потенциалом и их селективность невелика. В таких электродах мембрана изготавливается путем смешивания активного вещества с инертной матрицей. Практическое значение имеет ионселективный электрод с мембраной из сульфида серебра, пригодный для измерения активности и Ag+- и S2- -ионов. На основе сульфида серебра конструируются также различные галогенидные и металлочувствительные электроды. Жидкостные ИСЭ имеют жидкую мембрану. В таких электродах раствор сравнения отделен от анализируемого тонким слоем органической жидкости, содержащей жидкий ионит, не смешивающийся с водой, но селективно реагирующий с определяемым ионом. Слой ионочувствительной органической жидкости получается пропиткой этой жидкостью пористой гидрофобной мембраны из пластика. Электроды такого типа существуют для Са2+, Na+, K+, NH4+. Сконструированы газочувствительные мембранные электроды для определения NH3, NO и некоторых других газов. В последнее время стали широко использовать пленочные электроды, в которых вместо жидкой мембраны используют тонкую пленку. У пленочных электродов такой же механизм действия, что и у мембранных, но они долговечнее и более удобны в работе. 1.2.3. Селективность ИСЭ.
ИСЭ можно охарактеризовать количественно, используя уравнение Никольского. Оно описывает зависимость потенциала электрода от концентрации посторонних ионов при помощи коэффициента селективности. В случае одного постороннего иона уравнение Никольского выглядит так:
где а i – активность определяемого иона с зарядом zi, а j – активность определяемого иона с заря дом zj, Kpotij – потенциометрический коэффициент селективности. В общем случае, при наличии m мешающих ионов:
Коэффициент селективности показывает, при каком соотношении концентраций определяемого и постороннего иона последний начинает оказывать мешающее влияние. Значения коэффициентов селективности изменяются от весьма малых величин. Близких к нулю, до единицы и более. Чем меньше величина коэффициента селективности, тем выше селективность электрода. Так, коэффициент селективности, равный 1∙ 10-3, означает, что чувствительности электрода по отношению к определяемому и постороннему ионам относятся как 1000: 1. Наиболее предпочтительным способом определения коэффициента селективности является способ, основанный на исследовании растворов, содержащих смеси определяемого и постороннего иона. Для этого получают серии градуировочных зависимостей потенциала электрода от концентрации определяемого иона, построенных в присутствии различных концентраций постороннего иона (рис.2).
Рис.2. Определение коэффициента селективности ИСЭ из градуировочных зависимрстей, построенных в присутствии посторонних ионов с концентрацией 10-2 М (верхний график) и 10-3 М (нижний график). В данном случае коэффициент селективности равен 9.5 ∙ 10-3.
При больших избытках посторонних ионов потнциал электрода определяется вторым слагаемым в уравнении Никольского. Он остается постоянным и не зависит от концентрации определяемого иона (горизонтальный участок на градуировочной кривой). Из абсциссы точки пересечения двух участков градуировочной зависимости – горизонтального и наклонного – равной ai =Kijpot∙ajz(i)/z(j), можно, зная постоянную величину aj, рассчитать коэффициент селективности. Описанный метод в принципе позволяет рассчитать коэффициент селективности даже по одной градуировочной зависимости, но для большей достоверности надо использовать несколько.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 703; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.29.209 (0.007 с.) |

 (1.3)
(1.3) (1.4)
(1.4)
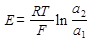 (1.5)
(1.5) (1.6)
(1.6)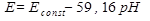 (1.7)
(1.7) (1.8)
(1.8) (1.9)
(1.9)



