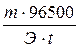Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электродные потенциалы и электродвижущие силыСодержание книги
Поиск на нашем сайте
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие: Ме + m Н2О ® Ме(H2O)mn+ + n ē, в растворе на металле где п - число электронов, принимающих участие в процессе. На границе металл - жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях - так называемые стандартные электродные потенциалы (Е0). Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 250 С условно принимается равным нулю (Е0 = 0; DG0 = 0). Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е0), получаем так называемый ряд напряжений. Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е0, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньше окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае DG0<0, так как DG0 = - n F E0.
Таблица 8 Стандартные электродные потенциалы (Е0) некоторых металлов (ряд напряжений)
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (таблица 8). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта - в растворе с концентрацией 0,1 моль/л. Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
где Е0 - стандартный электродный потенциал; n - число электронов, принимающих участие в процессе; С - концентрация (при точных вычислениях - активность) гидратированных ионов металла в растворе, моль/л; Е0 для никеля и кобальта соответственно равны -0,25 и -0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля. Пример 2. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен -2,41 В. Вычислите концентрацию ионов магния (в моль/л). Решение. Подобные задачи решаются также на основании уравнения Нернста (см. пример 1): 2,41 = - 2,37 + - 0,04 = 0,0295 lg C, lgC = - С Mg2+ = 4,4×10 –2 моль/л. Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнения окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС. Решение. Схема данного гальванического элемента: (-) Mg | Mg2+ || Zn2+ | Zn (+) Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс: Mg 0 -2ē = Mg 2+ (8.1) Цинк, потенциал которого -0,763 В, - катод, т. е. электрод, на котором протекает восстановительный процесс: Zn 2+ + 2 ē = Zn 0 (8.2) Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов: Mg 0 + Zn 2+ = Mg 2+ + Zn 0
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов: 8.1 Контрольные вопросы 81. При какой концентрации Zn 2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л. 82. Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn 2+ (в моль/л). Ответ: 1,89×10 -2 моль/л. 83. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb2+] = [Мg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В. 84. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде. 85. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В. 86. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3×10 -15 моль/л. 87. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, а [Рb2+] = 0,0001 моль/л. Ответ: 0,064 В. 88. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора? 89. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора? 90. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. Пример 1. Какая масса меди выделится на катоде при электролизе раствора СuSO4 в течение 1 часа при силе тока 4 А? Решение. Согласно законам Фарадея: m = где т - масса вещества, окисленного или восстановленного на электроде; Э - эквивалентная масса вещества; I - сила тока. А; t - продолжительность электролиза, с. Эквивалентная масса меди в СuSO4 равна 63,54: 2 = 31,77 г/моль. Подставив в формулу (9.1) значения Э = 31,77 г/моль, I = 4 А, t = 60×60 = 3600 с, получим: m = Пример 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла. Решение. Из формулы (9.1): Э = где т = 11,742 г; I×t = Q = 3880 Кл. Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)? Решение. Из формулы (1):
I = Так как дан объем водорода, то отношение т /Э заменяем отношением Vн2/Vэ(н2) где Vн2 - объем водорода, л; Vэ(н2) - эквивалентный объем водорода, л. Тогда I = Vн2×96500/ Vэ(н2)×t. Эквивалентный объем водорода при н.у. равен половине молярного объема 22,4/2== 11,2 л. Подставив в приведенную формулу значения Vн2 = 1,4 л, Vэ(н2) = 11,2 л, t = 6025 c (1 ч 40 мин 25 с), находим I = 1,4×96500/11,2×6025 = 2 А. Пример 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н. у.)? Решение. Эквивалентный объем кислорода (н.у.) 22,4/4 = 5,6 л. Следовательно, 11,2 л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11×2 = 112,22 г (56,11 г/моль - мольная и эквивалентная масса КОН).
9.1 Контрольные вопросы 91. Электролиз раствора K2SO4 проводили при силе тока 5А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде, аноде? Ответ: 5,03 г; 6,266 л; 3,133 л. 92. При электролизе соли некоторого металла в течение 1,5 ч при силетока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17,37 г/моль. 93. Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14,62 л; 7,31 л. 94. Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде? Ответ: 32,20 г; 1,67 л. 95. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла. Ответ; 32,7 г/моль. 96. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5,74 А. 97. Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах и вычислите массу вещества, выделившегося на катоде и аноде. Ответ: 0,56 г; 71,0 г. 98. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов и водных растворов NаС1 и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при силе тока 0,5 А? Ответ: 0,052 л. 99. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г. 100. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 газа? Сколько литров газа (н.у.) выделилось при этом на катоде? Ответ: 17,08 А; 8,96 л.
Коррозия металлов
При решении задач этого раздела см. таблицу 8. Коррозия - это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. При электрохимической коррозии на поверхности металла одновременно протекают два процесса: анодный - окисление металла Ме0 – nē = Ме n+ и катодный - восстановление ионов водорода 2 H+ + 2ē = H2 или молекул кислорода, растворенного в воде, О2 + 2 Н2O + 4ē = 4 OН -. Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозии во влажном воздухе при комнатной температуре - деполяризатором является кислород. Пример. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом. анодный процесс: Zn0 - 2ē = Zn2+ катодный процесс: в кислой среде 2 Н+ + 2ē = Н2 в нейтральной среде: 1/2O2 + Н2O + 2ē = 2 OН -. Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(ОН)2.
11.1 Контрольные вопросы 101. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процесса. 102. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 103. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции. 104. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. 105. Железное изделие покрыли никелем. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и втором случаях? 106. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов. 107. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде. 108. Какое покрытие металла называется анодным и какое - катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и кислой среде. 109. Железное изделие покрыли кадмием. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях? 110. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
Приложение Б
Таблица Б Степень диссоциации кислот и оснований в водных 0,1 н растворах при 180С
Приложение В
Таблица В Распределение некоторых кислот, оснований и солей по группам в зависимости от величины степени диссоциации
Приложение Г
Таблица Г Названия солей некоторых кислот
Библиографический список
а) основной
1. Глинка Н.Л. Общая химия. М.: Химия, 1977 – 1982. - 704 с. 2. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 1998. – 744 с. 3. Князев Д.А., Смарыгин С.Н. Неорганическая химия. - М.: Высшая школа, 1990. – 430 с. 4. Фролов В.В. Химия. - Л.: Химия, 1986. – 350 с. 5. Кульман А.Г. Общая химия. – М.: Колос, 1979. – 430 с. 6. Лучинский Г.П. Курс химии. - М.: Высшая школа, 1979. – 480 с.
б) дополнительный
1. Кузьменко Н.Е., Еремин В.В., Ионков В.А. Начала химии. Современный курс для поступающих в вузы. М. 1998. 1, 2 том. 2. Химия. Учебник для 8-11 классов средней школы.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 349; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.81.47 (0.009 с.) |

 Е = Е0 +
Е = Е0 + 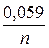 lgC,
lgC,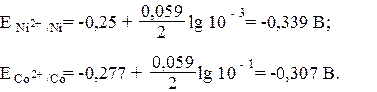
 lgC
lgC = -1,3559
= -1,3559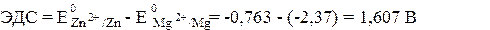
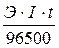 , (9.1)
, (9.1)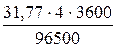 = 4,74 г
= 4,74 г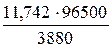 = 29,35 г/моль,
= 29,35 г/моль,