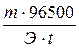Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодическая система элементовСодержание книги
Поиск на нашем сайте
Уфа - 2008
Рекомендовано к изданию методической комиссией факультета механизации сельского хозяйства. (протокол № от «____» _______________ 2008 г.) Председатель методической комиссии: д.т.н., профессор Баширов Р.М.
Составители: профессор Кудашев Р.Х. доцент Халимов Р.Ф.
Рецензент: доцент кафедры химии Шабаева Г.Б.
Ответственный за выпуск: заведующий кафедрой химии, доцент Нигматуллин Н.Г.
Введение Курс общей химии включает в себя материал, необходимый для формирования у будущих высококвалифицированных специалистов – инженеров сельского хозяйства химического мышления, которое в дальнейшем поможет им решать разнообразные производственные и исследовательские задачи. Необходимо, чтобы студент, изучая курс общей химии, обращал особое внимание на те разделы и даже отдельные вопросы курса, которые ближе всего отвечают профилю избранной им специальности: самопроизвольное протекание химических реакций, управление химическими процессами изменением скорости химической реакции и смещением химического равновесия, окислительно-восстановительные реакции, коррозию металлов и способы защиты от коррозии, полимеры и др. Настоящие методические указания составлены в соответствии с программой курса химии. Одной из форм учебы студента является самостоятельная работа с рекомендуемой литературой. В связи с этим главная задача методических указаний – оказание помощи обучающимся в освоении, систематизации и закреплении знаний по изучаемой дисциплине. Приступая к изучению курса целесообразно вначале ознакомиться с программой по химии. В соответствии с учебным планом каждый студент должен выполнить одну домашнюю работу, являющуюся результатом самостоятельной проработки курса. Своевременно представленная домашняя работа служит основанием для допуска студента к экзамену по химии. Домашнюю работу следует писать аккуратно, разборчиво. Для замечаний рецензента необходимо оставлять поля. Условие задачи необходимо записывать полностью и указывать номера задач в соответствии с домашним заданием.
Таблица 1 Варианты контрольного задания
последние две цифры зачетки 00 1,11,21,31,41,51,61,71,81,91,101 01 2,12,22,32,42,52,62,72,82,92,102 02 3,13,23,33,43,53,63,73,83,93,103 03 4,14,24,34,44,54,64,74,84,94,104 04 5,15,25,35,45,55,65,75,85,95,105 05 6,16,26,36,46,56,66,76,86,96,106 06 7,17,27,37,47,57,67,77,87,97,107 07 8,18,28,38,48,58,68,78,88,98,108 08 9,19,29,39,49,59,69,79,89,99,109 09 10,20,30,40,50,60,70,80,90,100,110 10 9,11,29,31,50,51,70,71,90,91,110 11 8,12,28,32,49,52,69,72,89,92,109 12 7,13,27,33,48,53,68,73,88,93,108 13 6,14,26,34,47,54,67,74,67,94,107 14 5,16,25,35,46,55,66,75,86,95,106 15 4,15,24,36,45,56,65,76,85,96,105 16 3,18,23,37,44,57,64,77,87,97,104 17 2,19,22,38,43,58,63,78,83,98,103 18 1,20,21,40,42,59,62,79,82,99,102 19 10,17,30,39,41,60,61,80,81,100,101 20 8,11,21,32,43,54,65,76,87,98,110 21 9,12,21,32,42,53,64,75,86,99,109 22 7,13,22,33,44,55,65,76,87,100,108 23 6,14,23,34,43,54,63,74,85,91,107 24 5,15,24,31,45,53,64,73,81,92,106 25 4,16,25,32,46,52,65,72,82,93,105 26 3,17,26,33,47,51,67,71,83,94,104 27 2,18,27,34,48,56,68,72,84,95,103 28 1,19,28,35,49,57,69,73,85,96,102 29 10,20,29,36,50,58,70,74,86,97,101 30 6,18,30,37,41,59,69,75,87,98,102 31 5,17,29,38,42,60,68,76,88,99,103 32 4,16,28,39,43,60,67,77,89,100,104 33 3,15,27,40,44,60,66,78,90,91,105 34 2,14,26,39,45,59,65,79,89,92,106 35 1,13,25,38,46,58,64,80,88,93,107 36 7,12,24,37,47,57,63,80,87,94,108 37 8,11,23,36,48,56,62,79,86,95,109 38 9,20,22,35,49,55,61,78,86,96,110 39 10,19,21,34,50,54,62,77,85,97,109 40 9,18,30,33,51,53,63,76,84,98,108 41 8,17,29,32,50,52,64,75,83,99,107 42 7,16,28,31,49,51,65,74,82,100,106 43 6,15,27,40,48,60,66,73,81,99,105 44 5,14,26,39,47,59,67,72,82,98,104 45 4,13,25,38,46,58,68,71,90,97,103 46 3,11,30,31,50,51,70,71,90,100,110 47 2,12,29,32,49,52,69,72,89,99,109 48 1,13,28,33,48,53,68,73,88,98,108 49 10,14,27,34,47,54,67,74,87,97,107 50 9,15,26,35,46,55,66,75,86,96,106 51 8,16,25,36,45,56,65,76,85,95,105 52 7,17,26,37,44,57,64,77,84,94,104 53 6,18,23,38,43,58,63,78,83,93,103 54 5,19,22,39,42,59,62,79,82,92,102 55 4,20,21,40,41,60,61,80,81,91,101 56 3,20,21,40,50,60,62,79,81,100,110 57 2,19,22,39,49,59,63,78,82,99,109 58 1,18,23,38,48,58,64,77,83,98,109 59 1,17,24,77,47,57,65,76,84,97,107 60 2,16,25,36,46,56,66,75,85,96,106 61 3,15,26,35,45,55,67,74,86,95,105 62 4,14,27,34,44,54,68,73,87,94,104 63 5,13,28,33,43,53,69,72,88,93,103 64 6,12,29,32,42,52,70,71,89,92,102 65 7,11,30,31,41,51,69,72,90,91,101 66 8,20,30,40,41,60,68,73,90,91,110 67 9,19,29,39,42,59,67,74,89,92,109 68 10.18,28,38,43,58,66,75,88,93,108 69 10,17,27,37,44,57,65,76,87,94,107 70 9,16,26,36,45,56,64,77,86,95,106 71 8,15,25,35,46,55,63,78,85,96,105 72 7,14,24,34,47,54,62,79,84,97,104 73 6,13,23,33,48,53,61,80,83,98,103 74 5,12,22,32,49,52,70,80,82,99,102 75 4,11,21,31,40,51,69,79,81,100,104 76 3,11,22,31,50,52,68,78,82,100,101 77 2,12,23,32,49,53,67,77,83,99,102 78 1,13,24,33,48,54,66,76,84,98,103 79 10,14,25,34,47,55,65,75,85,97,104 80 9,15,26,35,46,56,64,73,86,96,105 81 8,16,27,36,45,57,63,74,87,95,106 82 7,17,28,32,44,58,62,71,88,94,107 83 6,18,29,38,43,59,61,72,89,93,108 84 5,19,30,39,42,60,70,79,90,92,109 85 4,20,29,40,41,60,69,80,89,91,110 86 3,20,28,40,50,59,68,77,88,100,109 87 2,19,27,39,49,58,67,76,87,99,108 88 1,18,26,38,48,57,66,75,86,98,107 89 1,17,25,37,47,56,65,74,85,97,106 90 2,16,24,36,46,55,64,73,84,96,105 91 3,15,23,35,45,54,63,72,83,95,104 92 4,14,22,34,44,53,62,71,82,94,103 93 5,13,21,33,43,52,61,72,81,93,102 94 6,12,21,32,42,51,62,73,90,92,101 95 7,11,22,31,41,60,63,74,89,91,101 96 8,12,23,31,50,59,64,75,88,92,102 97 9,13,24,32,49,58,65,76,87,93,103 98 10,14,25,33,48,57,66,77,86,94,104 99 9,15,26,34,47,56,67,78,85,95,105
Задания и методические указания по выполнению домашней работы Строение атома Каждая цифра в таблице Д.И. Менделеева имеет определенный физический смысл. Поэтому характеристики и схему строения атома любого элемента можно определить по положению его в таблице. Пример 1. Составьте схему строения атома элемента №16. Решение. Элемент №16 – сера, химический знак S. Для элементов малых периодов главных подгрупп удобно пользоваться следующей схемой: Таблица 2. Схема строения атома серы.
Пример 2. Титан (Ti) расположен в 4 периоде четвертой группы в побочной подгруппе. Его четыре валентных электрона распределены так: 2ē – на 4-м слое, а 2ē помещен вместе с восемью имеющимися на третьем слое. Схема строения: ядро атома Ti электронные слои атома Ti
))))
валентные электроны
1.2 Контрольные вопросы 1-10. Составьте электронные формулы и представьте графически размещение электронов по квантовым ячейкам для указанных в таблице 3 элементов, соответствующих вашему заданию. Проанализируйте возможности разъединения спаренных электронов при возбуждении атомов с образованием валентных электронов в соответствии с теорией спин-валентности.
Таблица 3 Задания к номерам 1-10
Периодическая система элементов Д.И. Менделеева
Пример 1. Какую высшую степень и низшую степени окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Решение. Высшую степень окисления элемента определяет номер группы периодической системы Д.И. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6). Данные элементы находятся соответственно в VA, VIA, VIIA-группах и имеют структуру внешнего энергетического уровня s2p3, s2p4 и s2p5. Ответ на вопрос см. в таблице 4. Таблица 4 Степени окисления мышьяка, селена, брома
Пример 2. У какого из элементов четвертого периода – марганца или брома – сильнее выражены металлические свойства? Решение. Электронные формулы данных элементов: 25Mn 1s22s22p63s23p63d54s2 35Br 1s22s22p63s23p63d104s24p5 Марганец – d-элемент VIIB-группы, а бром – p-элемент VIIA-группы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно приобретают отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у марганца сильнее выражены, чем у брома.
2.1 Контрольные вопросы 11. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s - и p -элементов в группах периодической системы с увеличением порядкового номера? Почему? 12. Что такое электроотрицательность? Как изменяется электроотрицательность р -элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему? 13. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента. 14. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте исходя из строения атомов данных элементов. 15. У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена. 16. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения? 17. У какого из р -элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атомов этих элементов. 18. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и азот? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. 19. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. 20. Атомы каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5? Какой их них дает газообразное соединение с водородом? Составьте формулы кислот, отвечающих этим оксидам, и изобразите их графически.
Химическая термодинамика Химическая термодинамика изучает превращение энергии при протекании химических реакций и способность химических систем совершать полезную работу. Энтальпия Н – одна из термодинамических функций состояния системы. Изменение энтальпии ΔН равно тепловому эффекту химической реакции, протекающей в изобарно-изотермических условиях (р=const, T= const), причем единственным видом работы является работа расширения газа (W = p∙ΔV). Если ΔН < 0, процесс идет с выделением теплоты в окружающую среду (экзотермическая реакция), если ΔН > 0, процесс идет с поглощением теплоты (эндотермическая реакция). Закон Гесса. Тепловой эффект химического процесса не зависит от пути протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции. В основе расчетов тепловых эффектов реакций лежат следующие положения. Первое следствие из закона Гесса. Тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции с вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов реакции: ΔrH0298 = Σ(ν1 Δ f H0298)прод - Σ(νi Δ f H0298)исх, (3.1.) где ΔrH0298 – тепловой эффект химической реакции; Δ f H0298 – энтальпия образования исходных веществ и продуктов реакции при стандартных условиях (таблицы 5); ν1, νi – стехиометрические коэффициенты. Стандартная энтальпия образования Δ f H0298 – тепловой эффект образования одного моля вещества из простых веществ, устойчивых при стандартных условиях (Т= 298 К, р= 1 атм). Стандартные теплоты образования простых веществ в стандартных состояниях и устойчивых модификациях равны нулю. Второе следствие из закона Гесса. Тепловой эффект химической реакции равен сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов реакции: ΔrH0298 = Σ(νi Δ f H0298)исх - Σ(ν1 Δ f H0298)прод, (3.2.) где ΔrH0298 – тепловой эффект химической реакции; Δ f H0298 – энтальпия сгорания исходных веществ и продуктов реакции при стандартных условиях; ν1, νi – стехиометрические коэффициенты. Стандартная энтальпия сгорания вещества ΔсH0298 – уменьшении энтальпии при окислении в избытке кислорода 1 моля вещества, взятого в стандартном состоянии, до конечных продуктов окисления: оксида углерода (IV), воды, азота, оксида серы (IV). Стандартные энтальпии сгорания конечных продуктов окисления равны нулю. Энтропия S так же, как энтальпия Н, является термодинамической функцией состояния системы S= R∙lnW, (3.3) где R - универсальная газовая постоянная; W- термодинамическая вероятность состояния системы. Уравнение 3.3 – уравнение Больцмана. Термодинамическая вероятность состояния системы W – число микросостояний, с помощью которых осуществляется данное микросостояние. Так как величина S прямо пропорциональна ln W, то энтропия является мерой неупорядоченности системы. Ее значение увеличивается с ростом температуры и уменьшается с ее понижением. Энтропия возрастает при переходе вещества из твердого состояния в жидкое и из жидкого в газообразное, таким образом, S (т) < S (ж) < S (г). Усложнение молекулы сопровождается ростом энтропии. Так как энтропия является функцией состояния системы, то ее изменение (ΔS) в процессе химической реакции можно подсчитать, используя следствие из закона Гесса: ΔrS0298 = Σ(νi S0298)прод - Σ(ν1 S0298)исх, (3.4.) где ΔrS0298 – изменение энтропии при протекании химической реакции; Δ S0298 – стандартная энтропия исходных веществ и продуктов реакции (таблицы 7); ν1, νi – стехиометрические коэффициенты Э нергия Гиббса. При химических взаимодействиях наблюдается одновременные изменения и энтальпии, и энтропии системы, которые учитываются энергией Гиббса ΔG, поэтому ΔG – критерий, определяющий направление самопроизвольного протекания химических процессов. Если ΔG < 0 – химическая реакция возможна; ΔG > 0 – протекание реакции невозможно; ΔG = 0 – реакция находится в состоянии химического равновесия. Стандартную энергию Гиббса реакции можно рассчитать двумя способами. 1 способ. Используют первое следствие из закона Гесса: Δr G0298 = Σ(νi Δf G0298)прод - Σ(ν1 Δf G0298)исх, (3.5) Δr G0298 – изменение энергии Гиббса при протекании химической реакции; Δf G0298 – энергия Гиббса образования исходных веществ и продуктов реакции при стандартных условиях (таблицы 6); ν1, νi – стехиометрические коэффициенты. Стандартная энергия Гиббса образования Δf G0298 – изменение энергии Гиббса при образовании одного моля вещества из простых веществ, устойчивых при стандартных условиях (Т= 298 К, р= 1 атм). стандартные значения энергий Гиббса образования простых веществ в стандартных состояниях и устойчивых модификациях равны нулю. 2 способ. Изменение стандартной энергии Гиббса химической реакции может быть также вычислено по уравнению: Δr G0298 = Δr Н0298 - Т∙ Δr S0298, (3.6) где Δr Н0298 – изменение энтальпии химической реакции, рассчитанное по уравнению 1.1 или 1.2; ∙ Δr S0298, - изменение энтропии химической реакции, рассчитанное по уравнению 3.4; Т – температура, К. Если пренебречь зависимостью Δr Н0 и Δr S0 от температуры, то можно определить Травн, т.е. температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
Прежде чем приступить к решению задач, выучите следующие основные понятия: 1) термодинамическая система, виды термодинамических систем (гомогенные, гетерогенные, открытые, закрытые, изолированные); 2) параметры термодинамической системы (экстенсивные, интенсивные); 3) термодинамические процессы (изобарные, изохорные, изотермические; обратимые и необратимые; самопроизвольные и вынужденные; экзо- и эндотермические); 4) внутренняя энергия, теплота, работа; первый закон термодинамики; 5) важнейшие функции состояния системы (энтальпия, энтропия, энергия Гиббса) и взаимосвязь между ними; 6) стандартная энтальпия образования вещества и стандартная энтальпия сгорания вещества, стандартное изменение энтальпии реакции; закон Гесса и следствия из него. При решении задач необходимо обратить внимание на то, что: 1) при записи термохимических (термодинамических) уравнений обязательно указывают агрегатное состояние исходных и полученных веществ, а справа указывают величину Δr Н0298; 2) при расчете стандартной энергии Гиббса по уравнению 3.6 единицы измерения величины Δr Н0 и произведения Т∙ Δr S0298 должны совпадать; 3) направление протекания самопроизвольного химического процесса можно определить по знаку изменения стандартной энергии Гиббса процесса.
Примеры решения типовых задач Расчет стандартной энтальпии реакции по стандартным энтальпиям образования веществ. 3.1. Сколько теплоты выделится при сжигании 25 литров этилена, взятого при нормальных условиях, если известны стандартные энтальпии образования веществ. Решение. Запишем уравнение процесса: С2Н4 (г) + 3О2 (г) → 2СО2 (г) + 2Н2О (ж) По условию задачи сгорает 25 литров этилена, что составляет
где Vm = 22,4 л/моль – мольный объем любого газа при нормальных условиях. Используя стандартные энтальпии образования веществ, рассчитаем, какое количество теплоты выделяется при сгорании 1 моль этилена. Исходя из первого следствия из закона Гесса, стандартная энтальпия химической реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов: ΔrH0298 = Σ(νi Δ f H0298)исх - Σ(ν1 Δ f H0298)прод Тепловой эффект данной реакции рассчитывается по уравнению ΔrH0298 = 2∙Δ f H0298 (СО2) + 2∙ Δ f H0298 (Н2О) - Δ f H0298 (С2Н4) - 3∙ Δ f H0298 (О2). Подставив справочные данные, получим: ΔrH0298 = 2∙(-393,5) + 2∙(-286,0) – 52,0 = -1411,0 кДж. Следовательно, при сжигании 1 моль этилена выделится 1411,0 кДж, тогда при сжигании 1,12 моль этилена 1,12∙(-1411,0 кДж) = -1580,3 кДж. Данная реакция является экзотермической, так как ΔrH0298 < 0. Ответ: при сжигании 25 л этилена выделится 1580,3 кДж теплоты. Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. Пример 1. Какая масса меди выделится на катоде при электролизе раствора СuSO4 в течение 1 часа при силе тока 4 А? Решение. Согласно законам Фарадея: m = где т - масса вещества, окисленного или восстановленного на электроде; Э - эквивалентная масса вещества; I - сила тока. А; t - продолжительность электролиза, с. Эквивалентная масса меди в СuSO4 равна 63,54: 2 = 31,77 г/моль. Подставив в формулу (9.1) значения Э = 31,77 г/моль, I = 4 А, t = 60×60 = 3600 с, получим: m = Пример 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла. Решение. Из формулы (9.1): Э = где т = 11,742 г; I×t = Q = 3880 Кл. Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)? Решение. Из формулы (1):
I = Так как дан объем водорода, то отношение т /Э заменяем отношением Vн2/Vэ(н2) где Vн2 - объем водорода, л; Vэ(н2) - эквивалентный объем водорода, л. Тогда I = Vн2×96500/ Vэ(н2)×t. Эквивалентный объем водорода при н.у. равен половине молярного объема 22,4/2== 11,2 л. Подставив в приведенную формулу значения Vн2 = 1,4 л, Vэ(н2) = 11,2 л, t = 6025 c (1 ч 40 мин 25 с), находим I = 1,4×96500/11,2×6025 = 2 А. Пример 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н. у.)? Решение. Эквивалентный объем кислорода (н.у.) 22,4/4 = 5,6 л. Следовательно, 11,2 л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11×2 = 112,22 г (56,11 г/моль - мольная и эквивалентная масса КОН).
9.1 Контрольные вопросы 91. Электролиз раствора K2SO4 проводили при силе тока 5А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде, аноде? Ответ: 5,03 г; 6,266 л; 3,133 л. 92. При электролизе соли некоторого металла в течение 1,5 ч при силетока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17,37 г/моль. 93. Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14,62 л; 7,31 л. 94. Электролиз раствора нитрата серебра проводили при силе тока 2А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде? Ответ: 32,20 г; 1,67 л. 95. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла. Ответ; 32,7 г/моль. 96. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5,74 А. 97. Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах и вычислите массу вещества, выделившегося на катоде и аноде. Ответ: 0,56 г; 71,0 г. 98. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов и водных растворов NаС1 и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при силе тока 0,5 А? Ответ: 0,052 л. 99. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г. 100. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 газа? Сколько литров газа (н.у.) выделилось при этом на катоде? Ответ: 17,08 А; 8,96 л.
Коррозия металлов
При решении задач этого раздела см. таблицу 8. Коррозия - это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. При электрохимической коррозии на поверхности металла одновременно протекают два процесса: анодный - окисление металла Ме0 – nē = Ме n+ и катодный - восстановление ионов водорода 2 H+ + 2ē = H2 или молекул кислорода, растворенного в воде, О2 + 2 Н2O + 4ē = 4 OН -. Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии - коррозии во влажном воздухе при комнатной температуре - деполяризатором является кислород. Пример. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом. анодный процесс: Zn0 - 2ē = Zn2+ катодный процесс: в кислой среде 2 Н+ + 2ē = Н2 в нейтральной среде: 1/2O2 + Н2O + 2ē = 2 OН -. Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(ОН)2.
11.1 Контрольные вопросы 101. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процесса. 102. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 103. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции. 104. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. 105. Железное изделие покрыли никелем. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и втором случаях? 106. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов. 107. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде. 108. Какое покрытие металла называется анодным и какое - катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и кислой среде. 109. Железное изделие покрыли кадмием. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях? 110. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
Приложение Б
Таблица Б Степень диссоциации кислот и оснований в водных 0,1 н растворах при 180С
Приложение В
Таблица В Распределение некоторых кислот, оснований и солей по группам в
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-22; просмотров: 148; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.239.65 (0.01 с.) |


 I II III IV
I II III IV 2ē 8ē 8ē + 2ē 2ē
2ē 8ē 8ē + 2ē 2ē (3.7)
(3.7)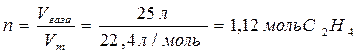
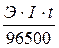 , (9.1)
, (9.1)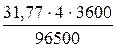 = 4,74 г
= 4,74 г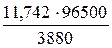 = 29,35 г/моль,
= 29,35 г/моль,