Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение электродных потенциалов металловСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Теоретическая часть.
Любой металл обладает растворимостью в электролите, пусть даже ничтожной. Если металлическую пластинку погрузить, к примеру, в воду, то ионы металла в результате действия на них полярных молекул воды могут отрываться от поверхности и переходить в прилегающий к ней слой воды; так что нейтральный до того атом превращается в положительно заряженный ион:
Ме o ® Ме n+ + n ē. (1)
В этом процессе неизбежно высвобождаются электроны, в итоге прилегающий к поверхности слой металла заряжается этими электронами отрицательно. Слой воды, содержащий положительные ионы металла создает разность потенциалов по отношению к отрицательному слою внутри пластины вблизи ее поверхности. Под действием этой разности потенциалов ионы металла концентрируются вблизи поверхности пластины, образуя так называемый адсорбционный слой. Создавшаяся структура представляет собой так называемый двойной электрический слой (рис. 10.). Процесс носит динамический характер, так что в электролите у поверхности металла создается определенное перераспределение концентраций ионов растворителя и металла и молекул растворителя. Итак, взаимодействие металла с водой или раствором, содержащим ионы этого металла, приводит к образованию у поверхности двойного электрического слоя и появлению разности потенциалов между металлом и раствором. Эта разность потенциалов включает в себя падение потенциала в слое адсорбированных на поверхности ионов (jа) и падение потенциала в растворе (в диффузионном слое (jд):
j = jа + jд. (2)
Толщина двойного слоя в водных растворах не превышает 0,002 мм.
Адсорбционный Диффузионный слой слой
Рис. 10. Строение двойного электрического поля.
Переход ионов из металла в раствор – процесс обратимый и изотермический, здесь система совершает максимальную полезную работу А, характеризуемую изобарно-изотермическим потенциалом Гиббса DG°р:
Aэл = - DG = - n × F× j (3)
где n - заряд иона; j - разность потенциалов между металлом и раствором, В; F - число Фарадея. Равновесие имеет динамический характер: часть ионов приповерхностного слоя диффундирует в электролит, другие ионы из раствора замещают их. В результате равновесная концентрация ионов металла у поверхности электрода С0 оказывается иной, чем средняя концентрация ионов в растворе С. Изотермическая работа по перемещению 1 моля ионов между приповерхностным слоем и объемом раствора определяется как:
А = R×T× ln(С0/С). (4)
Из условия равенства этих работ следует:
DG° = - n× F× j = R×T× ln(С0/С). (5)
Отсюда может быть найден потенциал электрода:
R×T j = ______ × ln (С/С0). (6) n×F
Концентрацию С0 определить экспериментально невозможно, поэтому потенциал изолированного электрода, погруженного в раствор электролита, рассчитать не представляется возможным. Однако можно определить разность потенциалов (ЭДС = DЕ = j2 – j1) между одинаковыми электродами, погруженными в раствор собственного иона, но с различной концентрацией, так называемый концентрационный элемент:
R×T R×T j2 – j1 = _____ [ln(С2/С0) – ln(С1/С0)] = ______ ln(С2/С1), (7) n×F n×F
или для стандартных условий (298 К) и после замены натурального логарифма на десятичный:
j2 – j1 = (0,059/n) × lg(С2/С1). (8)
В электрохимии принято измерять электродные потенциалы металлов в вольтах, обозначаемые Е, по отношению к некоторому стандартному электроду сравнения, потенциал которого условно принят за нуль. По международному соглашению в качестве такого электрода сравнения применяется стандартный водородный электрод (см. рис. 11.), а условной величиной, характеризующей потенциал рассматриваемого электрода, принимают ЭДС гальванического элемента, составленного из этого электрода и стандартного водородного электрода. Эту величину называют электродным потенциалом данного электрода и обозначают буквой Ео. Таким образом, принимая концентрацию ионов металла в адсорбционном слое С0 = 1моль/л, получаем ЭДС элемента, составленного из металлов одного вида, но с разной концентрацией ионов в растворе: R×T DЕ = Е - Ео = ¾¾ × ln(CMen+), (9) n×F
или: R×T Е = Ео + ¾¾ × ln(CMen+), (10) n×F
где CMen+ – молярная концентрация ионов. Это уравнение называется уравнением Нернста. Уравнение (10) является приближенным, поскольку не учитывает межионного взаимодействия в растворах электролитов. Для учета этого взаимодействия вводится активность иона, связанная с его концентрацией следующим соотношением:
a = f × C, (11)
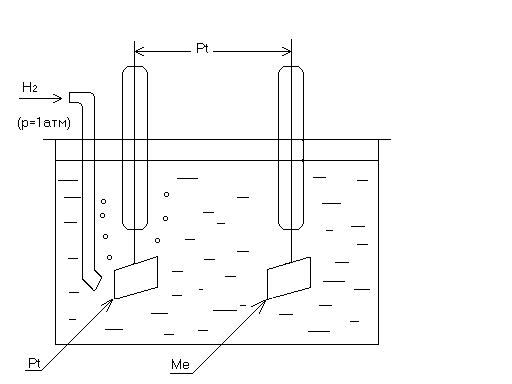
где f - коэффициент активности. Стандартный водородный электрод сравнения представляет собой платиновый электрод (проволока или пластинка), покрытый платиновой чернью, способной адсорбировать водород. Электрод погружен в раствор серной кислоты с активностью ионов Н+, равной 1 г-ион/л, и насыщен газообразным водородом под давлением 1 атм (101325 Па). На границе платина - раствор устанавливается равновесие:
Н2, адс ⇄ 2Н+ + 2ē. (12)
Схема водородного электрода приведена на рис. 11. Поскольку платина не участвует в электродной реакции (ее роль сводится лишь к поглощению водорода и перемещению электронов от одного электрода к другому), химический символ платины в схеме водородного электрода заключается в скобки: (Pt)H2/ 2H+.
Рис. 11. Схема стандартного водородного электрода.
Для измерения стандартного электродного потенциала собирают гальваническую цепь из двух полуэлементов: стандартного водородного электрода и измеряемого электрода (например, цинкового), погруженного в раствор с одноименными ионами при их активности, равной 1 г-ион/л:
⊖ Zn | Zn2+ || H+ | H2 (Pt) ⊕ (13) aZn2+ = 1 aH+ = 1
При работе элемента на цинковом электроде происходит реакция:
Zn ® Zn2+ + 2ē, (14)
а на водородном электроде реакция:
2Н+ + 2ē ® Н2. (15)
Будучи источником электронов, цинковый электрод имеет отрицательный потенциал. Суммарная реакция, протекающая в этом элементе:
Zn +2H+ ® Zn2+ + H2. (16)
Стандартный электродный потенциал цинкового электрода E°Zn/Zn2+ рассчитывается как DЕ рассмотренного гальванического элемента. Стандартный электродный потенциал водородного электрода принят равным нулю E°Н2/Н+ = 0. Химическая реакция, определяющая электрохимический процесс, самопроизвольно протекает в направлении уменьшения изобарно-изотермического потенциала DG°р (изменение свободной энергии Гиббса для процесса растворения металла). Если во время реакции произойдет восстановление и окисление n молей однозарядных ионов, то по закону Фарадея будет перенесено количество электричества, равное n×F Кл, а химическая работа Ахим = n×F×DЕ, тогда, согласно формуле (5):
DG°р = – n×F×DЕ, (17)
где F = 96484 Кл/моль» 96,5 кКл/моль. Например, для гальванического элемента Zn | Zn+2 || Cu+2| Cu
DЕ = ЕCuкат – ЕZnанод = +1,1В, (18)
DG°р = – n×F×DЕ = – 2×(96,5)×(+1,1) = – 213,3 кДж/моль, (19)
В данном случае DG°р< 0, следовательно, электрохимический процесс
Znо + Cu+2 ® Zn+2 + Cuо (20)
протекает самопроизвольно. Для измерения ЭДС обратимого гальванического элемента применяется компенсационный метод Поггендорфа. Шкала потенциалов, в которой за нуль отсчета принят потенциал стандартного водородного электрода, называется водородной шкалой. Отрицательный стандартный потенциал в этой шкале принадлежит тем электродам, которые по отношению к водородному заряжаются отрицательно (Eо < 0); положительный потенциал означает, что электрод заряжается положительно по отношению к водородному электроду (Eо > 0). По характеру протекающих окислительно-восстановительных реакций, участию электрода в них, обмениваемым ионам все электроды делятся на три вида: электроды I рода, обратимые относительно катиона или аниона; электроды II рода и окислительно-восстановительные, или редокс-электроды. Электроды I рода, обратимые относительно катиона, это металлы, погруженные в раствор, содержащий ионы того же металла, например, Cu|Cu2+, Zn|Zn2+ (вертикальная черта изображает поверхность раздела двух фаз, где имеется скачок потенциала). Эти электроды обратимо обменивают катионы Меn+ + n ē ® Мео, (22)
где n - число теряемых (или приобретаемых) электронов. Стандартные электродные потенциалы (по водородной шкале) электродов I рода, обратимых относительно катиона, расположенные последовательно в порядке их возрастания, дают ряд активностей металлов, или ряд напряжений (см. приложение 1). Рядом напряжений широко пользуются в практике при создании гальванических элементов, источников тока, а также при изучении взаимодействия между металлами и кислотами, солями и металлами. Зная ряд напряжений, можно предвидеть направление реакции вытеснения одних элементов другими. Так, металлы, стоящие в ряду напряжений после водорода, не способны вытеснять водород из кислот. Вытеснение металла из солей другим металлом происходит в том случае, если вытесняющий металл расположен в ряду напряжений до вытесняемого. При составлении гальванического элемента в качестве положительного электрода берется металл, обладающий более высоким значением стандартного потенциала в ряду напряжений, а в качестве отрицательного - металл с более низким потенциалом. К электродам I рода, обратимым относительно аниона, относятся галоидные электроды, кислородный и серный, обратимо обмениващие анионы, например, хлорный электрод (Pt)Cl2/Cl– (an–), у которого протекает электродная реакция:
1/2Cl2 + ē ® Cl– (23)
Уравнение для расчета электродных потенциалов этих электродов также имеет вид: Е = Ео + (0,059/n) × lg(an-). (24)
Эти электроды, расположенные в порядке возрастании электродных потенциалов, образуют ряд активности неметаллов (см. приложение 1). Электроды II рода состоят из металла, покрытого слоем труднорастворимой соли и погруженного в раствор какой-либо легкорастворимой соли с тем же анионом, например, хлорсеребряный электрод: Ag÷AgCl,КСl(нас.). Этот электрод представляет собой серебряную проволоку, покрытую слоем хлорида серебра, помещенную в раствор КСl (чаще всего насыщенный) или НСl. Потенциал электрода возникает на границе раздела Ag÷Ag+, при этом имеет место электродная реакция AgCl + ē ® Ag + Cl–. Электроды II рода, в особенности хлорсеребряный электрод, часто применяются при измерении электродных потенциалов в качестве электрода сравнения вместо стандартного водородного электрода, приготовление и эксплуатация которого представляют значительные трудности. Хлорсеребряный электрод обладает устойчивым и отлично воспроизводимым потенциалом, который зависит от концентрации (активности) ионов хлора в растворе н выражается уравнением: E = E°xc – 0,059 × lg [Cl–], где E°xc – стандартный потенциал хлорсеребряного электрода. Потенциал хлорсеребряного электрода имеет положительный знак по отношению к стандартному водородному электроду. В насыщенном растворе хлорида калия E°xc = 0,202 В при 25° С. К редокс-электродам относятся полуэлементы, в которых окисленная и восстановленная формы вещества находятся в растворе, а электродная реакция осуществляется на инертном электроде (платина, уголь). Примером редокс-электродов могут служить электроды: Fe3+ôFe2+ (Pt); Sn4+ôSn2+ (Pt); MnO4– ôMn2+(Pt).
Экспериментальная часть. Цель работы -определить электродные потенциалы Cu, Pb, Zn, Fe, Ni. Изучить изменение величины электродного потенциала цинка в зависимости о концентрации раствора соли цинка. Оборудование и реактивы. 1. Высокоомный милливольтметр типа "рН-340", датчик ДЛ-2 с хлорсеребрянным электродом сравнения Ag÷AgCl,КСl(нас.), потенциал его равен +0,202 В. 2. Набор металлических электродов: медь Cu, свинец Pb, железо Fe, никель Ni, цинк Zn. 3. Водные 1М растворы солей меди, свинца, железа, никеля, водные растворы соли цинка с концентрациями 0,1; 0,5; 1,0 и 1,5 М.
Порядок выполнения работы: Работа проводится в два этапа: на первом этапе измеряются стандартные электродные потенциалы металлов при их погружении в растворы соответствующих солей с концентрациями 1 моль/л; на втором этапе исследуется зависимость электродных потенциалов одного металла (цинка) при погружении его в растворы соли цинка с различными концентрациями: 0,1М; 0,5М; 1,0М и 1,5М. 1. Получить набор электродов. 2. Перед измерениями каждый раз зачищать наждачной бумагой поверхность электрода. 3. Последовательно подсоединять исследуемые электроды к датчику ДЛ-2, составляя гальваническую цепь из измеряемого электрода и хлорсеребряного электрода сравнения. Оба электрода при этом должны быть погружены в раствор соответствующей соли необходимой концентрации, на первом этапе это будут 1М растворы, на втором – соли цинка с различными концентрациями: 0,1М; 0,5М; 1,0М и 1,5М. 4. Работа на приборе. Ручку переключателя «Род работы» установить в положение «+мВ» – при измерении потенциала медного электрода, или «–мB» — при измерении потенциалов прочих электродов. 5. Ручка переключателя «Размах» первоначально должна быть в положении «1500 мВ». 6. Ручку переключателя «Температура раствора» установить на значение температуры раствора электролита, которая равна комнатной. 7. Ручку переключателя «Пределы измерений» установить в положение, соответствующее первому интервалу измерения «–1–2». 8. Произвести ориентировочный отсчет величины ЭДС по нижней шкале, оцифрованной от «–1» до «14». 9. Ручку переключателя «Пределы измерения» перевести в положение, соответствующее тому диапазону измерений, в который укладывается отсчет по нижней шкале прибора, рукоятку «Размах» перевести в положение «300 мВ». 10. Произвести отсчет величины ЭДС по верхней шкале, при этом нулевое значение верхней шкалы будет соответствовать нижнему пределу выбранного интервала измерения, то есть –1, 2, 5, 8 и так далее, а значение "3" верхней шкалы 2, 5, 8 и так далее, соответственно. Таким образом, к показанию по верхней шкале прибора должно быть прибавлено значение нижнего предела выбранного интервала измерения. 11. Подсчитать величину измеренной ЭДС (DЕ) в мВ. Для этого полученное показание прибора умножить на 100, а для перевода значения ЭДС в Вольты – поделить на 1000. 12. По окончании измерения ЭДС ручку «Размах» перевести в положение «1500мВ», а ручку переключателя «Пределы измерения» снова поставить на первый предел «–1–2». 13. В промежутках между измерениями хлорсеребряный электрод должен быть погружен в дистиллированную воду, а ручка «Размах» поставлена в положение «1500 мВ». 14. По завершении измерений отсоединить металлический электрод от прибора, погрузить хлорсеребряный электрод сравнения в стакан с дистиллированной водой.
Обработка результатов. 1. По измеренной величине DЕ и значению потенциала электрода сравнения (0,202В) рассчитать потенциалы исследуемых металлических электродов: ECu/Cu2+ = DЕ + Eхс; ЕZn/Zn2+ = Exc –½DЕ½; ЕNi/Ni2+ = Exc –½DЕ½; ЕFe/Fe2+ = Exc –½DЕ½; ЕPb/Pb2+ = Exc –½DЕ½.
2. Результаты представить в виде таблицы (табл. 14.). Таблица 14.
3. Записать исследованные металлы в порядке возрастания их стандартных электродных потенциалов, сопоставить эту последовательность с известным рядом напряжений. 4. Потенциалы цинка в растворах различной концентрации рассчитать по уравнению Нернста (10) и записать по форме таблицы 15. 5. Сопоставить табличные и теоретически рассчитанные с экспериментально измеренными величинами электродных потенциалов и найти процент ошибки. Таблица 15.
Литература.
1. Угай Я.А. Общая химия. - М, Высшая школа. 1984. 2. Глинка Н. Л. Общая химия: — Л.: Химия, 1976. 3. Мешковский И.K., Новиков А.Ф. и др. Пособие по самостоятельному изучению разделов курса "Общая химия" для студентов инженерных специальностей (Конденсированное состояние вещества. Основы теории протекания химических процессов). Учебное пособие. ЛИТМО, 1989. 4. Новиков А.Ф., Успенская М.В. Электронный учебник по курсу химии, глава 9. Элeктрoхимичeскиe систeмы, раздел 9.1, 9.2. Центр дистанционного обучения СПб.ГУИТМО, 2004.
Лабораторная работа № 6
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 995; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.179.120 (0.01 с.) |