
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электродные потенциалы и электродвижущая сила.Содержание книги Поиск на нашем сайте
Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах, состоящих из следующих частей: 1. Проводники второго рода, обладающие ионной проводимостью (электролиты). 2. Проводники первого рода – вещества, обладающие электронной проводимостью, находящиеся в контакте с электролитом. На границе раздела двух фаз происходит перенос электрического заряда, т.е. протекает электрохимическая реакция. Такая система, состоящая из проводников первого и второго рода, называется электродом. 3. Проводники, обеспечивающие прохождение тока между электродами. Химические превращения, которые происходят в растворах или расплавах на электродах из проводников первого рода, называются электродными процессами. Эти процессы можно разделить на две группы, тесно связанные друг с другом. Во-первых, это возникновение разности потенциалов и электрического тока в гальванических элементах. Во-вторых, обратные им химические процессы, которые имеют место при прохождении постоянного электрического тока через раствор или расплав, называемые электролизом. Электрод представляет собой систему, состоящую как минимум из двух фаз. Характерная особенность электрохимической системы заключается в том, что вещества, учавствующие в суммарной токообразующей реакции, пространственно разделены. Поэтому реакция распадается на две частные реакции, каждая из которых совершается на отдельном электроде. Состояние заряженной частицы в фазе определяется электрохимическим потенциалом
где zi – заряд иона, g – внутренний потенциал, отвечающий работе переноса элементарного отрицательного заряда из бесконечности в вакууме вглубь фазы. Равновесие электрохимической системы характеризуется равенством электрохимических (а не химических) потенциалов заряженных частиц в различных фазах. Рассмотрим, как возникает скачок потенциала – электродный потенциал — на границе границе раздела металл–раствор. При погружении металлической пластинки в воду некоторая часть ионов металла с поверхности пластинки в результате взаимодействия с молекулами воды переходит в раствор, прилегающий к поверхности пластинки. Металл заряжается отрицательно, и возникающие электростатические силы препятствуют дальнейшему протеканию этого процесса. В системе устанавливается равновесие. Указанные процессы приводят к возникновению двойного электрического слоя и скачка потенциала между отрицательно заряженной пластинкой и слоем положительно заряженных ионов в растворе. Толщина двойного электрического слоя в разбавленных растворах составляет сотни ангстрем, а в концентрированных уменьшается до нескольких ангстрем.
Для ионов, находящихся в равновесной системе растворI/электродII, имеем:
Работа перенесения иона из фазы I в фазу II равна
так как
В равновесии
где φ – абсолютный электродный потенциал, т.е. скачок потенциала между двумя фазами. Обозначим
где φо ‑ стандартный электродный потенциал (скачок потенциала на границе раздела фаз при аi = 1). Стандартный потенциал представляет собой величину, характерную для данного электродного процесса, и зависит от температуры и природы растворителя. Тогда
Уравнение (9.7) называют уравнением Нернста для электродного потенциала. Разность внутренних потенциалов иона в двух фазах (g 2 – g 1) компенсирует разность химических потенциалов иона. Разность электрических потенциалов экспериментально можно измерить только между двумя точками одной и той же системы (μ i = const), поэтому электродный потенциал нельзя измерить абсолютно, только относительно. Разность потенциалов между электродами зависит от условий (температуры, природы металлов, активности ионов в растворе), в которых она определяется. Эта разность максимальна при равновесных условиях работы электрохимической системы, при которых внешнее сопротивление бесконечно велико, а ток в цепи – бесконечно мал. Такая разность потенциалов получила название электродвижущей силы (ЭДС).
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 347; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.11.69 (0.007 с.) |

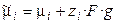 , (9.1)
, (9.1)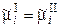 . (9.2)
. (9.2)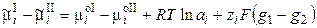 , (9.3)
, (9.3)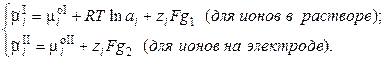 (9.4)
(9.4) , (9.5)
, (9.5) , (9.6)
, (9.6)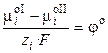 ,
, . (9.7)
. (9.7)


