
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила записи электродов и электрохимических цепей.Содержание книги Поиск на нашем сайте
Для электродов (полуэлементов): вещества, находящиеся в растворе, указываются слева от вертикальной черты, справа указываются вещества, образующие другую фазу, или электродный материал. Если одна фаза содержит несколько веществ, то их символы разделяются запятыми. Например,
Уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, справа – вещества в восстановленной форме:
Для электрохимических цепей: слева располагается электрод, имеющий более отрицательный потенциал; растворы обоих электродов отделяются друг от друга вертикальной пунктирной линией, если они контактируют друг с другом, и двумя сплошными линиями, если между растворами находится солевой мостик, с помощью которого устраняется диффузионный потенциал:
Справа всегда указывается положительно заряженный электрод, слева – отрицательно заряженный. В качестве примера электрохимической цепи, используемой на практике для получения электрической энергии, рассмотрим гальванический элемент, состоящий из серебряного и медного электродов, которые погружены соответственно в растворы AgNO3 и CuSO4. Схематически рассматриваемый элемент записывается в следующем виде:
где вертикальная линия обозначает поверхность раздела металл–раствор, а вертикальная пунктирная – поверхность раздела раствор–раствор. В результате работы элемента на медном электроде будут образовываться и переходить в раствор ионы меди (процесс окисления):
а на серебряном электроде будут разряжаться ионы серебра и осаждаться металлическое серебро (процесс восстановления):
Процессы окисления и восстановления в гальваническом элементе протекают раздельно. Электрод, на котором протекает процесс окисления (II), называется анодом и в гальваническом элементе заряжен отрицательно. Электрод, на котором протекает процесс восстановления (III), заряжен положительно и называется катодом. Реакции (II) и (III) называются электродными реакциями. Суммарный химический процесс, протекающий в элементе (I), слагается из отдельных процессов у электродов и выражается уравнением:
Если электродные процессы и химическая реакция в гальваническом элементе могут быть осуществлены в прямом (при работе элемента) и обратном (при пропускании электрического тока через элемент в противоположном направлении) направлениях, то такие электроды и гальванический элемент носят название обратимых. В частности гальванический элемент (I) можно отнести к обратимым элементам. При его работе протекают электродные процессы (II) и (III). При пропускании же через него электрического тока в обратном направлении на медном электроде будут разряжаться ионы Cu2+ и выделяться металлическая медь, а на серебряном электроде – образовываться и переходить в раствор ионы Ag+. В этом случае электрохимическая реакция (IV) будет протекать справа налево. Примером необратимого электрода может быть, например, медь в растворе кислоты. В дальнейшем будут рассматриваться только обратимые гальванические элементы.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1829; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.17.137 (0.005 с.) |

 .
. ,
,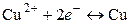 ,
, .
. .
.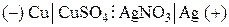 , (I)
, (I)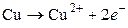 , (II)
, (II)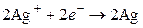 . (III)
. (III) . (IV)
. (IV)


