
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительные электроды. ⇐ ПредыдущаяСтр 7 из 7
Все электроды, которым соответствуют потенциалопределяющие реакции с участием электронов, являются окислительно-восстановительными системами. Однако принято в особую группу выделять электроды, в потенциалопределяющих реакциях которых не участвуют простые вещества – газы, металлы. Их называют окислительно-восстановитель-ными (редокс -электроды). Как правило, эти электроды состоят из инертного вещества с электронной проводимостью (например, платина), погруженного в раствор, содержащего вещества с различной степенью оксления Red и Ox. Металл обменивается электронами с участниками окислительно-восстановительной реакции и принимает определенный потенциал при установлении равновесия в системе. Его роль сводится к подводу и отводу электронов к веществам, реагирующим на поверхности электрода. В общем виде схема электрода и уравнение электродной реакции записывается в следующем виде:
Потенциал редокс-электрода определяется по уравнению
К окислительно-восстановительным относятся в первую очередь электроды, в которых Ox и Red являются ионами, а электродная реакция состоит в перемене их заряда. Например, системам
соответствуют следующие потенциалопределяющие реакции:
Пример 9.2. Определить величину редокс–потенциала железного электрода в растворе, в котором активность ионов Fe2+ в 10 раз больше активности ионов Fe3+. Стандартный потенциал электрода при 20 оС равен Решение. По уравнению
находим Так как то стандартному значению редокс – потенциала железного электрода отвечает следующее значение константы равновесия:
Кроме рассмотренных, относительно простых редокс-электродов, существует более сложные окислительно-восстановительные электроды, в потенциалопределяющих реакциях которых участвуют ионы Н+ и молекулы воды. Наиболее используемым из таких электродов на практике является хингидронный электрод, представляющий собой платиновую пластинку, погруженную в исследуемый раствор, в который добавлено небольшое количество хингидрона – эквимолекулярного соединения хинона и гидрохинона С6Н4О2·С6Н4(ОН)2. В воде это соединение малорастворимо и распадается на хинон С6Н4О2 и гидрохинон С6Н4(ОН)2. Схема электрода и потенциаопределяющая реакция следующие:
Потенциал хингидронного электрода равен
где а Х и а ХГ – активности хинона и гидрохинона. Так как хинон и гидрохинон малорастворимы, то их активности можно принять равными концентрациям, а поскольку последние равны между собой, то а Х = а ХГ. Тогда
С учетом того, что
где εэ.с. – потенциал электрода сравнения, Е – ЭДС гальванического элемента, составленного из электрода сравнения и хингидронного электрода. Хингидронный электрод может быть использован для измерения рН кислых и слабощелочных растворов (до рН = 8), не содержащих окислителей и восстановителей. Достоинством электрода является простота устройства и быстрое установление равновесного потенциала. Пример 9.3. Определить рН раствора, если при 298 К ЭДС элемента
равна 0,15 В. Стандартный потенциал хингидронного электрода при этой температуре равен 0,699 В, потенциал каломельного электрода ‑ 0,337 В. Решение.
Системы с большими положительными редокс–потенциалами являются окислителями по отношению к системам с менее положительными или отрицательными потенциалами. При контакте таких систем протекают реакции «окисление Для геологии важно, что величина окислительно–восстановительного потенциала в природных водах отражает равновесное окислительно-восстановительное состояние всех находящихся в данной воде систем, содержащих элементы с переменной валентностью. Поэтому величина электродного потеницала служит наиболее общим показателем окислительно-восстановительного режима вод и отражает условия их формирования. Так, восходящие минеральные воды характеризуются обычным восстановительным состоянием, а в зоне выветривания происходят окислительные процессы. На величину редокс–потенциала вод большое влияние оказывает соприкосновение их с кислородом — основным окисляющим фактором земной поверхности. Наиболее восстановленными из природных вод нашей страны оказались горячие воды Пятигорска, а наиболее окисленными — природные воды, доступные воздействию кислорода воздуха, например, нарзан из каптажного колодца в Кисловодске.
Ионообменные электроды. Электрохимические системы, состоящие из ионита (ионитовой мембраны) и раствора электролита, называют мембранными ионообменными электродами. Потенциал на границе раздела фаз возникает за счет ионообменных процессов между ионитом и раствором. Допустим, что ионит содержит ионы L+,способные к обмену с ионами М+, находящимися в растворе:
Эта реакция характеризуется константой равновесия (обмена), которая определяет степень замещения ионов одного рода в ионите ионами другого рода из раствора:
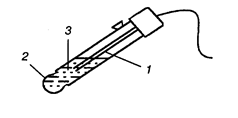
При установлении равновесия в системе поверхность ионита и раствор приобретают электрические заряды противоположного знака, на границе раздела ионит-раствор возникает двойной электрический слой, которому соответствует скачок потенциала. Так как иониты обладают повышенной избирательной способностью к обмену с определенным видом ионов, находящихся в растворе, ионообменные электроды называются также ионселективными. Отличительной чертой этих электродов является то, что в соответствующих им электродных реакциях не участвуют электроны, потенциал электрода определяется степенью обмена ионами раствора и ионита (мембраны). Наиболее распространенным мембранным электродом в настоящее время является стеклянный электрод (рис. 9).Он представляет собой тонкую мембрану из специального стекла, в котором повышено содержание щелочных составляющих – соединений натрия, лития и др. Стеклянный электрод применяется для определения рН растворов и активности ионов щелочного металла.
Рис. 9. Стеклянный электрод. 1 — внутренний электрод Ag, AgCl / HCl; 2 — стеклянная мембрана; 3 — внутренний раствор, HCl. Потенциалопределяющий процесс на границе раствор-стекло заключается в обмене между ионами щелочного металла, например Na+, содержащимися в стекле, и ионами Н+, находящимися в растворе:
константа обмена
Обозначив К = 1/ К об, потенциал границы раствор-стекло определяется уравнением
т. е. зависит от активностей ионов H+ и Na+ в растворе, т.е. поверхность стеклянной мембраны обладает свойствами и водородного, и натриевого электродов. Водородная функция проявляется в кислых и слабощелочных растворах (рН до 10-12), в сильнощелочных растворах граница раствор-стекло ведет себя как натриевый электрод. Если опустить стеклянный электрод в исследуемый раствор, то по обе стороны мембраны будут находится растворы с различными активностями ионов Н+. На границах раздела стекла с этими растворами возникают потенциалы φ´ и φ΄΄. Разность между этими потенциалами называют потенциалом стеклянного электрода:
В настоящее время с использованием стекол специального состава и различных ионитов разработаны ионселективные электроды, при помощи которых определяется содержание в растворах многих катионов, анионов и органических веществ.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 650; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.107.149 (0.01 с.) |
 ,
, .
. .
. ,
,  ,
, 
 ,
,  ,
,  .
. =0,771 В.
=0,771 В.
 .
. ,
,  ,
,
 ,
, .
. ,
, .
. , получаем
, получаем ,
,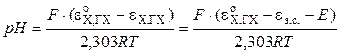 ,
,
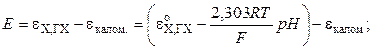
 ;
; .
. восстановление», ведущие к установлению общего окислительно-восстановительного потенциала с каким–то промежуточным значением.
восстановление», ведущие к установлению общего окислительно-восстановительного потенциала с каким–то промежуточным значением. .
. .
.
 ,
, .
. ,
, .
.


