
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение Нернста для ЭДС гальванического элемента.
Электрической характеристикой электрода является потенциал, а гальванического элемента (электрохимической цепи) ‑ электродвижущая сила (ЭДС), равная алгебраической сумме скачков потенциала, возникающих на границе раздела фаз, входящих в состав цепи. ЭДС электрохимической цепи соответствует разности потенциалов правого (положительного) и левого (отрицательного) электродов и всегда положительна. ЭДС гальванического элемента (I) равна:
где
где Е о – стандартная ЭДС гальванического элемента. Тогда
Следует помнить, что активность чистого твердого вещества принимается равной единице. Уравнение (9.8) носит название уравнения Нернста для ЭДС гальванического элемента. Пусть в гальваническом элементе протекает обратимая химическая реакция
Максимальная полезная работа гальванического элемента при стандартных условиях равна
где z – число электронов, участвующих в элетродных реакциях (одинаковое для обоих электродов), F – постоянная Фарадея. По уравнению изотермы Вант-Гоффа
или
Следовательно,
Уравнение Нернста в форме (9.14) применимо для расчета ЭДС любого гальванического элемента (по суммарной химической реакции) и потенциала любого электрода (по электродной реакции Стандартный ВОДОРОДНЫЙ ЭЛЕКТРОД. ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. Можно с высокой точностью измерить ЭДС цепи, составленной из двух электродов. Однако нельзя ни измерить, ни вычислить абсолютную разность потенциалов φ на границе металл–раствор. Для практических целей достаточно иметь условные величины, характеризующие потенциалы различных электродов, отнесенные к потенциалу некоторого электрода, выбранного за стандартный. В качестве условно-нулевого потенциала выбран потенциал стандартного водородного электрода:
в котором давление продуваемого водорода равно 1 атм, а активность ионов водорода в растворе равна 1 (рис. 7). Электродная реакция
Рис. 7. Общий вид водородного электрода. Потенциал стандартного водородного электрода равен
С учетом того, что
R = 8.314 Дж·моль-1·К-1, F = 96485 Кл·моль-экв-1, и заменяя натуральный логарифм десятичным, получаем
Электродным потенциалом любого другого электрода называют его потенциал по отношению к стандартному водородному. Другими словами, за электродный потенциал принимают ЭДС цепи, составленной из рассматриваемого электрода и стандартного водородного электрода. При этом справа в цепи расположен рассматриваемый электрод, а слева – стандартный водородный электрод. ЭДС положительна (электродный потенциал положителен), если электрический ток внутри цепи течёт слева направо, и отрицательна – если наоборот. Пример 9.1. 1). Составим гальванический элемент из платинового и медного электродов:
Суммарная токообразующая реакция:
2). Составим гальванический элемент из платинового и цинкового эдектродов:
Суммарная реакция:
Следует помнить, что ЭДС цепи всегда положительна, поэтому рассматриваемый гальванический элемент следует записать в следующем виде:
при стандартных условиях
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 639; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.35.148 (0.005 с.) |
 (9.8)
(9.8) и
и  – активности ионов Ag+ и Cu2+ в растворах их солей. Обозначим
– активности ионов Ag+ и Cu2+ в растворах их солей. Обозначим , (9.9)
, (9.9) . (9.10)
. (9.10) .
. , (9.11)
, (9.11) , (9.12)
, (9.12) . (9.13)
. (9.13) . (9.14)
. (9.14) ,
, .
.
 ,
, ,
, .
. .
. , т.е. перенос электронов в цепи происходит слева направо (от левого электрода к правому). При стандартных условиях (
, т.е. перенос электронов в цепи происходит слева направо (от левого электрода к правому). При стандартных условиях ( )
)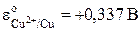 .
. .
. , т.е. перенос электронов в цепи происходит справа налево. При стандартных условиях (
, т.е. перенос электронов в цепи происходит справа налево. При стандартных условиях ( )
) .
. ,
, .
.


