
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Для слабых и сильных электролитов.Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Электропроводность растворов зависит от концентрации ионов в растворе, природы электролита, природы растворителя, температуры, степени диссоциации. Графическая зависимость удельной электропроводности водных растворов от концентрации проходит через точку максимума. В разбавленных растворах сильных электролитов рост удельной электропроводности обусловлен увеличением количества ионов. Дальнейшее уменьшение c связано с увеличением сил электростатического притяжения ионов и уменьшением скорости движения ионов. В растворах слабых электролитов небольшой рост электропроводности объясняется увеличением концентрации электролита. С увеличением концентрации диссоциация электролита уменьшается, что приводит к уменьшению электропроводности. Эквивалентная электропроводность раствора слабого электролита возрастает с уменьшением концентрации, в основном, за счет увеличения числа переносчиков электричества – ионов в результате увеличения диссоциации. Разведение раствора сильного электролита почти не изменяет числа ионов в растворе, однако при этом увеличиваются расстояние между ионами, скорость движения ионов, уменьшаются взаимодействия между ионами, плотность ионной атмосферы. Чем выше концентрации или подвижности ионов, тем выше удельная электропроводность раствора. С увеличением концентрации растет ионная сила раствора и усиливаются межионные взаимодействия. Скорость движения ионов при этом уменьшается, т.к. ионная атмосфера тормозит движение иона. На движение иона влияет и вязкость раствора. Разбавление концентрированных растворов ведет вначале к увеличению c за счет уменьшения сил межионного взаимодействия (у сильных электролитов) или за счет резкого повышения степени диссоциации слабого электролита, а затем к постепенному её уменьшению (в результате уменьшения количества ионов). С увеличением разведения l растет и в области разбавленных растворов стремится к предельному значению.
Удельная и эквивалентная электропроводности раствора повышаются с ростом температуры, т.к. при этом увеличивается скорость движения ионов и уменьшается вязкость раствора. Подвижности ионов при температуре t могут быть вычислены по уравнению
Скорость движения ионов также определяется градиентом потенциала (напряженности) электрического поля E (В/см), сопротивлением среды, зависящим от температуры, природы иона и растворителя:
где U (В) – разность потенциалов между электродами, l (см) – расстояние между ними, ui (см2/В·с) – абсолютная скорость движения ионов в данных условиях.
Эквивалентная электропроводность слабых и сильных электролитов увеличивается с разбавлением (рис. 5 б). Для слабых электролитов это обусловлено в основном тем, что с увеличением разведения степень диссоциации слабого электролита возрастает и в пределе стремится к 1. Рост эквивалентной электропроводности сильных электролитов связан в основном с изменением подвижностей ионов. Подвижность ионов тем меньше, чем больше концентрация раствора. В области сильно разбавленных растворов подвижности ионов достигают своего предельного значения. Рис. 5. Зависимость удельной (а) и эквивалентной (б) электропроводности от концентрации раствора электролита. Удельная электропроводность для сильных электролитов тем выше, чем больше концентрация ионов и чем больше их абсолютные скорости (подвижности). Наибольшей удельной электропроводностью обладают кислоты, затем основания, далее идут соли, очень мала электропроводность растворов таких слабых электролитов, как уксусная кислота или аммиак. Кривые зависимостей удельной электропроводности от концентрации имеют максимумы (рис. 5 а). В разбавленных растворах слабых и сильных электролитов рост удельной электропроводности с концентрацией обусловлен увеличением числа ионов, переносящих электричество. Дальнейшее увеличение концентрации сопровождается увеличением вязкости раствора, что снижает скорость движения ионов и электропроводность. Более того, у слабых электролитов в концентрированных растворах заметно снижается степень диссоциации и, следовательно, общее число ионов. Для слабых электролитов скорость движения ионов почти не зависит от концентрации и в общем случае их удельная электропроводность изменяется с концентрацией незначительно. Для сильных электролитов в области разбавленных растворов межионные взаимодействия практически отсутствуют, но число ионов невелико — удельная электропроводность мала. С увеличением концентрации увеличивается число ионов в единице объёма, что приводит к росту удельной электропроводности. Однако в дальнейшем усиливающееся взаимодействие между ионами приводит к снижению подвижности ионов и рост электропроводности замедляется. Наконец, взаимодействие между ионами с ростом концентрации начинает увеличиваться настолько сильно, что приводит к уменьшению удельной электропроводности.
С позиций теории Дебая-Гюккеля уменьшение подвижности ионов с ростом концентрации обусловлено эффектами торможения движения ионов за счёт электростатического взаимодействия между ионом и ионной атмосферой. Эффект электрофоретического торможения обусловлен торможением движения центрального иона встречным движением ионной атмосферы и имеет гидродинамическую природу. Поскольку ионы гидратированы, то движение центрального иона происходит не в неподвижной среде, а в среде, перемещающейся ему навстречу. Движущийся ион находится под влиянием дополнительной тормозящей силы (силы электрофоретического торможения), что приводит к снижению скорости его движения. Эффект релаксационного торможения. Ионная атмосфера обладает сферической симметрией до тех пор, пока отсутствует внешнее электрическое поле. Как только центральный ион начинает движение под действием электрического поля, симметрия ионной атмосферы нарушается. Перемещение иона сопровождается разрушением ионной атмосферы в обном положении иона и формированием ее в ругом, новом. Этот процесс происходит с конечной скоростью в течение некоторого времени, называемого временем релаксации. В результате ионная атмосфера теряет центральную симметрию и позади движущегося иона всегда будет находиться некоторый избыток заряда противоположного знака, что и вызывает уменьшение его скорости движения. Плотность ионной атмосферы увеличивается с ростом концентрации электролита, что приводит к усилению эффектов торможения. Теория электрофоретического и релаксационного эффектов была разработана Л. Онзагером. Она количественно позволяет учесть влияние этих эффектов на величину эквивалентной электропроводности раствора электролита:
где постоянные (В 1·λ∞) и В 2 характеризуют влияние релаксационного и электрофоретического эффектов соответственно. В растворах с С → 0 эти эффекты практически не проявляются и
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 776; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.213.73 (0.01 с.) |

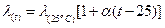 . Где α – температурный коэффициент электропроводности.
. Где α – температурный коэффициент электропроводности.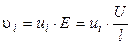 , (8.1)
, (8.1)
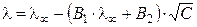 , (8.23)
, (8.23)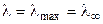 .
.


