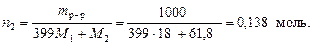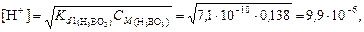Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет рН в растворах сильных кислот и основанийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для сильных кислот и щелочей, полностью диссоциированных на ионы,
где С к и С щ - моляльные концентрации кислоты и, соответственно, щелочи, z - основность кислоты или кислотность основания. Разбавление раствора сильного электролита учитывают по уравнениям:
где индекс 1 относится к исходному раствору (до разбавления), индекс 2 – к конечному раствору (после разбавления). В среде, близкой к нейтральной, необходимо принять во внимание диссоциацию воды, в результате которой образуются ионы Н+иОН -.
При смешивании растворов сильных кислот и оснований возможны два варианта. 1. рН1<7и рН2<7 или рН2>7ирН2>7, то есть смешивают два кислых или два щелочных раствора:
2. рН1<7, а рН2>7, то есть смешивают кислый и щелочной растворы. В этом случае конечную концентрацию раствора рассчитывают по веществу, взятому в избытке.
Расчет рН в растворах слабых кислот и оснований Диссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молей к общему числу молей электролита в растворе называют степенью диссоциации. Для его количественного описания используют константу равновесия, называемую константой диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению:
Т.к. [An–] = [H+] и [An] = C то
где С – концентрация слабой кислоты, моль/л Kd – константа диссоциации (приводится в справочниках). Для растворов слабых оснований:
где С - концентрация слабого основания, моль/л. По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита:
Многоосновные кислоты диссоциируют ступенчато, например: Н2S Û НS- + Н + (1-ая ступень); НS- Û S2- + Н+ (2-ая ступень). При расчетах рН обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, уравнения (62 и 64) справедливы и для многоосновных кислот при использовании первой константы диссоциации Kd 1. Примеры решения задач Пример 1. Вычислить рН раствора серной кислоты концентрацией 0,3 % (d = 1,0 г/см3). Решение. 1. Перейдем к моляльной концентрации серной кислоты. Для этого выделим мысленно 100 г раствора, тогда масса серной кислоты составит 0,3 г, а масса воды – 99,7 г. По уравнению (37) вычислим моляльную концентрацию:
2. По уравнению диссоциации H2SO4 ® 2H+ + SO42- из 1 моль серной кислоты образуется 2 моль H+, следовательно, 3. По уравнению (50) вычислим значение рН: рН = -lg[H+] = –lg0,062 = 1,21. Пример 2. Вычислить рН раствора гидроксида бария концентрацией 0,0068 экв/л. Решение. 1. По уравнению диссоциации Ba(OH)2 ® Ba2+ + 2 OH- из 1 моль гидроксида бария образуется 2 моль гидроксил-ионов: 3. По уравнению (50) найдем значение рОН: рOН = -lg[OH-] = -lg0,0068 = 2,17 и вычислим рН: рН = 14 - рОН = 14 – 2,17 = 11,83. Пример 3. Определить значение рН при разбавлении раствора одноосновной кислоты с рН = 5,5 в 100 раз. Решение. По уравнению (56) найдем концентрацию ионов водорода в конечном растворе [H+]2:
Пример 4. Определить значение рН при смешении 10 л раствора с рН = 2 и 17 л раствора с рН = 4. Решение. По уравнению (58) найдем концентрацию ионов водорода в конечном растворе [H+]3
и вычислим рН3: рН3 = -lg[H+]3 = -lg(4,6×10-3) = 2,33. Пример 5. Смешали 250 мл раствора (V 1) с рН = 3 и 300 мл раствора (V 2) гидроксида калия концентрацией 0,001 моль/л. Определить рН полученной смеси. Решение. 1. Найдем число молей OH-:
Согласно уравнению диссоциации: KOH ® K+ + OH-, 2. Найдем число молей H+:
3. Очевидно, что в избытке находятся гидроксил-ионы. Их остаточную концентрацию в полученном растворе найдем по уравнению: 4. Вычислим рН3 по уравнению: рН3 = 14 + lg[OH-]3 = 14 + lg(9,1×10-5) = 9,96. Пример 6. Найти рН раствора борной кислоты с мольной долей 0,0025 (d р-р = 1,0 г/см3). Решение. 1. выделим мысленно 1 кг раствора.
где индекс 1 относится к растворителю (т.е. к воде), а индекс 2 – к растворенному веществу, т. е. к H3BO3. M 1 = 18 г/моль, М 2 = 61,8 г/моль.
2. Так как плотность раствора равна 1 г/см3, то его объем соответствует 1 л и молярная концентрация численно равна количеству вещества борной кислоты, т. е. СМ (Н3ВО3) = 0,138 моль/л. 3. Диссоциация борной кислоты по первой ступени протекает по реакции: H3BO3 ® H+ + H2BO3-, для которой константа диссоциации Kd 1 = 7,1×10-10. Второй и третьей ступенями диссоциации борной кислоты пренебрегаем. 4. рН раствора борной кислоты вычисляем в соответствии с уравнением (63):
рН = -lg[H+] = -lg(9,9×10-6) = 5. Пример 7. Сколько граммов бутиламина содержится в 1 л его раствора, имеющего рН=11,5? Решение. 1. Гидрат бутиламина диссоциирует как основание по уравнению: C4H9NH2×H2O Û C4H9NH3+ + OH-. Константа диссоциации: Kd = 4,57×10-4, p Kd = 3,340. 2. рОН = 14 - рН = 2,5. 3. Из формулы (64) находим молярную концентрацию бутиламина lg CМ = p Kd – 2pOH = 3,34 - 2×2,5 = -1,66; CМ = 10-1,66 = 0,022 моль/л и массу бутиламина, содержащуюся в 1 л раствора: Сг/л = CМM, где М – молярная масса бутиламина 73 г/моль. Получаем С г/л =0,022×73 = 1,6 г/л. Задачи для решения I. Определить pH предложенного раствора сильного электролита
51. Найти рН раствора гидроксида бария концентрацией 0,1 моль/л, если к 1 л этого раствора добавили 7,1 г сульфата натрия. 52. Найти рН раствора серной кислоты концентрацией 0,1 моль/л, если к 1 л этого раствора добавили 7,1 г хлорида бария. 53. Найти рН раствора после выщелачивания боксита по следующим данным: масса руды 1 т; ω(Al2O3∙Н2O) = 80 %; V (NaOH)=3,1 м3; ω(NaOH)=15 %. 54. Найти рН 10 % раствора соляной кислоты (d = 1,047 г/мл) при условии, что к 20 л этого раствора прибавили 5 м3 воды, содержащей гидроксид кальция концентрацией 0,02 экв/л. 55. Определить рН раствора, содержащего 4 г KOH и 5 г NaOH в одном литре воды. 56. Определить рН раствора, содержащего 0,005 моль/л серной кислоты и 0,006 моль/л соляной кислоты. 57. Выщелачивание руды идет по реакции: Li2O∙Al2O3∙4SiO2+H2SO4→Li2SO4+ Al2O3∙4SiO2∙H2O↓. Определить рН раствора после выщелачивания по следующим данным: масса руды = 1 т; ω(Li2O∙Al2O3∙4SiO2)=70 %; V (H2SO4)=4 м3; ω(H2SO4)=5% (d =1,032 г/мл). 58. Найти рН раствора после выщелачивания руды при следующих условиях: масса руды – 1 т, в ней содержится 6 % Cu4(SO4)(OH)6; ω(H2SO4)=3 %, d =1,03 г/мл, V (H2SO4)=3 м3. 59. Рассчитайте рН раствора, полученного при разбавлении 20 л 10 % соляной кислоты (d =1,047 г/мл) пятью кубометрами воды. 60. Рассчитать рН раствора азотнокислых стоков, если 10 л 5 % азотной кислоты сброшены в резервуар емкостью 5 м3. 61. Найти рН раствора соляной кислоты, если к 100 мл этого раствора, содержащего 5 мг HCl, прибавили 5 мг нитрата свинца (II). 62. Определите рН 10 м3 раствора, содержащего по 50 г серной и дихромовой кислот. 63. Определить рН 5 л щелочных стоков, содержащих 2 мэкв щелочи. 64. Найти рН раствора дихромовой кислоты, если в нем содержится 2 мг/мл Cr (VI).
II. Определить pH и степень диссоциации предложенного раствора слабого электролита при температуре 25°С:
III. По заданному значению pH определить концентрацию предложенного раствора электролита при температуре 25°С и выразить ее всеми возможными способами (считать, что плотности растворов равны 1 г/см3).
IV. По заданному значению pH определить концентрацию предложенного раствора слабого электролита и выразить ее всеми возможными способами.
V. Определить pH при смешивании двух растворов электролитов:
195. Смешали 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л. Определить рН полученного раствора. 196. Определить объем раствора с рН = 3,8, если после добавления к нему 0,6 л раствора с рН=10,5 образовался раствор с рН = 4,2. 197. Найти объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствора с рН = 4,03. 198. Определить объем раствора с рН=10,13, если после добавления к нему 30 л раствора с рН = 9,76 образовался раствор с рН = 9,92. 199. Смешали 40 м3 раствора с рН = 6,7 и 2000 л раствора с рН = 8,3. Определить рН раствора после смешивания. 200. Определить объем раствора с рН=13,4, если после добавления к нему 40000 л раствора с рН = 4,8 образовался раствор с рН=8,5. 201. Определить рН раствора, если к 40 л раствора с рН=6,7, добавили 2 л раствора с рН = 8,3. 202. Смешали 2 л серной кислоты концентрацией 0,01 моль/л и 3 л щелочи с рН=12,5. Определить рН полученного раствора. 203. Определить объем раствора с рН = 11,3, если после добавления к нему 0,2 л раствора с рН=2,9 и 0,5 л раствора с рН = 3,5 образовался раствор с рН = 4,1. 204. Определить объем раствора с рН=2,14, если после добавления к нему 1,75 л раствора с рН = 11,85 образовался раствор с рН=10,23. 205. Смешали 0,2 л 0,5 н. HCl и 0,3 л 0,3 М NaOH. Определить рН раствора после смешивания. 206. Определить объем раствора с рН=10,13, если после добавления к нему 30 л раствора с рН = 9,76 образовался раствор с рН=9,92 207. Определить объем раствора с рН=3,4, если после добавления к нему 9,8 л раствора с рН = 9,8 образовался раствор с рН=4,6. 208. Определить рН раствора после смешивания 200 мл 0,5 н. раствора серной кислоты и 300 мл раствора едкого натра с концентрацией 0,3 моль/л. 209. Смешали 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты. Рассчитать рН полученного раствора. 210. Смешали 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария. Найти рН полученного раствора. 211. К 100 мл 0,2 % раствора едкого натра (NaOH) прибавили 200 мл 0,1 % раствора NaOH. Рассчитать рН полученного раствора. 212. К 200 мл 0,7 н. раствора серной кислоты прибавили 300 г воды. Рассчитать конечную концентрацию серной кислоты и определить рН раствора. 213. Смешали 54 мл 0,5 % раствора NaOH и 10 мл 0,2 % раствора NaOH. Рассчитать концентрацию полученного раствора и определить его рН. 214. Какое значение рН получится в растворе, если к 500 мл 0,3 % раствора КОН прибавить 500 мл воды? 215. Смешали 4 мл 0,46 % серной кислоты и 200 мл серной кислоты, концентрацией 0,001 моль/л. Рассчитать рН полученного раствора. 216. Смешали 8 л раствора соляной кислоты концентрацией 0,04 моль/л и 11 л раствора ее же концентрацией 2 г/л. Рассчитать рН полученного раствора. 217. К раствору объемом 30 мл, содержащему 0,109 г серной кислоты в 100 мл раствора, прибавили 40 мл раствора NaOH, содержащего 0,098 г гидроксида натрия в 100 мл раствора. Найти концентрацию (в моль/л) того вещества, которое останется в избытке, и вычислить рН полученного раствора. 218. Смешали 10 мл 0,12 % раствора HCl и 10 мл 0,076 % раствора HCl. Рассчитать процентную концентрацию и рН полученного раствора. 219. К 10 мл 6 % раствора соляной кислоты плотностью 1,03 г/см3 прибавили 10 мл 1 % раствора гидроксида бария плотностью 1,0 г/см3. Вычислить рН образующегося раствора.
VI. Определить pH раствора после соответствующего разведения:
Гидролиз Гидролизом называют процессы разложения химических соединений в результате реакции с водой. Гидролиз соли – это реакция, обратная процессу образования соли путем нейтрализации кислоты основанием.
Гидролизуются только соли, содержащие в своем составе ионы слабых электролитов: слабой кислоты или слабого основания.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2245; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.168.68 (0.012 с.) |

 .
.
 .
.
 ,
,
 .
.
 .
.
 .
.
 .
.
 и
и ,
,
 ,
,
 .
.



 и вычислим его рН: рН2 = -lg[H+]2 = -lg1,15×10-7 = 6,9.
и вычислим его рН: рН2 = -lg[H+]2 = -lg1,15×10-7 = 6,9.




 ,
,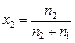 Þ
Þ  , подставим в уравнение п. 1:
, подставим в уравнение п. 1:  и найдем n 2:
и найдем n 2: