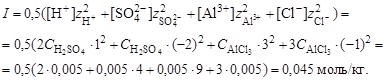Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотно-основные свойства растворов электролитовСодержание книги
Поиск на нашем сайте
Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма активности ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма активности ионов гидроксила:
рН + рОН = 14. (2.3) Равновесия в растворах сильных кислот и оснований Расчет рН в растворах сильных кислот и оснований Для сильных кислот и щелочей, полностью диссоциированных на ионы, [Н+] = zCк и [ОН-] = zCщ, (2.4) где С к и С щ - моляльные концентрации кислоты и, соответственно, щелочи, z - основность кислоты или кислотность основания. Пример 4. Вычислить рН раствора серной кислоты концентрацией 0,005 моль/кг в воде и в растворе хлорида алюминия концентрацией 0,005 моль/кг. Решение. 1. Составить уравнение диссоциации серной кислоты:
2. Согласно уравнению диссоциации концентрация катионов водорода 3. Оценить рН раствора по концентрации катионов водорода:
4. Вычислить ионную силу раствора:
5. Вычислить значение коэффициента активности катионов водорода:
6. Вычислить значение активности катионов водорода в растворе серной кислоты:
7. Вычислить значение рН:
8. Вычислить ионную силу раствора, содержащего серную кислоту и хлорид алюминия
9. Вычислить коэффициент активности катионов водорода
10. Вычислить рН раствора серной кислоты в присутствии хлорида алюминия
Вывод: увеличение ионной силы раствора приводит к снижению активности катионов водорода и снижению рН.
Задачи для решения I. Вычислить рН раствора сильного электролита в воде и в присутствии индифферентного электролита
II. Вычислить рН конечного раствора при смешении электролитов. Плотность раствора принять равной 1.
III. Вычислить рН раствора по приведенным ниже данным. 241. После выщелачивания боксита по следующим данным: масса руды 1 т; ω(Al2O3∙Н2O) = 80 %; V (NaOH)=3,1 м3; ω(NaOH)=15 %. 242. Если к 20 л раствора соляной кислоты концентрацией 10 % (d = 1,047 г/мл) было добавлено 5 м3 раствора гидроксида кальция концентрацией 0,02 экв/л. 243. Содержащего 4 г KOH и 5 г NaOH в одном литре воды. 244. Содержащего 0,005 моль/л серной кислоты и 0,006 моль/л соляной кислоты. 245. После выщелачивания руды по следующим данным: масса руды = 1 т; ω(Li2O∙Al2O3∙4SiO2)=70 %; V (H2SO4)=4 м3; ω(H2SO4)=5% (d =1,032 г/мл); уравнение реакции: Li2O∙Al2O3∙4SiO2 + H2SO4 = Li2SO4 + Al2O3∙4SiO2∙H2O↓. 246. После выщелачивания руды при следующих условиях: масса руды – 1 т, в ней содержится 6 % Cu4(SO4)(OH)6; ω(H2SO4)=3 %, d =1,03 г/мл, V (H2SO4)=3 м3. 247. Полученного при разбавлении 20 л 10 % соляной кислоты (d =1,047 г/мл) пятью кубометрами воды. 248. Азотнокислых стоков, если 10 л 5 % азотной кислоты сброшены в резервуар с водой емкостью 5 м3. 249. 10 м3 раствора, содержащего по 50 г серной и дихромовой кислот. 250. Содержашего дихромовую кислоту (2 мг/мл Cr (VI)) и азотную кислоту (1 мг/мл). 251. После смешивания 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л. 252. Найти объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствора с рН = 4,03. 253. После смешивания 2 л серной кислоты концентрацией 0,01 моль/л и 3 л щелочи с рН=12,5. 254. После смешивания 0,2 л 0,5 н. HCl и 0,3 л 0,3 М NaOH. 255. После смешивания 200 мл 0,5 н. раствора серной кислоты и 300 мл раствора едкого натра с концентрацией 0,3 моль/л. 256. После смешивания 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты. 257. После смешивания 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария. 258. После смешивания 100 мл 0,2 % раствора едкого натра (NaOH) и 200 мл 0,1 % раствора NaOH. 259. После смешивания 200 мл 0,7 н. раствора серной кислоты и 3000 г воды. 260. После смешивания 54 мл 0,5 % раствора NaOH и 10 мл 0,2 % раствора NaOH. 261. После смешивания 500 мл 0,3 % раствора КОН и 500 мл воды? 262. После смешивания 4 мл 0,46 % серной кислоты и 200 мл серной кислоты, концентрацией 0,001 моль/л. 263. После смешивания 8 л раствора соляной кислоты концентрацией 0,04 моль/л и 11 л раствора ее же концентрацией 2 г/л. 264. После смешивания 30 мл раствора, содержащего 0,109 г серной кислоты в 100 мл раствора, и 40 мл раствора NaOH, содержащего 0,098 г гидроксида натрия в 100 мл раствора. 265. После смешивания 10 мл 0,12 % раствора HCl и 10 мл 0,076 % раствора HCl. 266. После смешивания 10 мл 6 % раствора соляной кислоты плотностью 1,03 г/см3 и 10 мл 1 % раствора гидроксида бария плотностью 1,0 г/см3. 267. После смешивания 31 мл 0,16 н. раствора щелочи и 317 мл 0,02 н. раствора серной кислоты. 268. После смешивания 150 мл 0,4 н. раствора соляной кислоты и 250 мл 0,2 н. раствора гидроксида натрия. 269. После смешивания 4 мл серной кислоты концентрацией 40 % (плотность 1,303 г/см3) и 200 мл серной кислоты, концентрацией 0,001 моль/л. 270. После смешивания 8 л раствора соляной кислоты концентрацией 4 моль/л и 11 л раствора ее же концентрацией 2 г/л. 271. После смешивания 30 мл раствора, содержащему 10 г серной кислоты в 100 мл раствора, и 40 мл раствора NaOH, содержащего 9 г гидроксида натрия в 100 мл раствора. 272. После смешивания 500 мл раствора силиката натрия концентрацией 11 г/л и 500 мл раствора серной кислоты концентрацией 4,6 г/л. Дополнительно определить массу оксида кремния. 273. После смешивания 500 мл раствора гидроксида бария концентрацией 1,5 % (плотность 1,008 г/см3) и 300 мл 2 % раствора серной кислоты (плотность 1,012 г/см3). 274. После смешивания 500 мл 4 % раствора гидроксида натрия (плотность 1,043 г/см3) и 30 мл 2 % раствора серной кислоты (плотность 1,012 г/см3). 275. После смешивания 2 г гидроксида алюминия и 350 мл 1 % раствора соляной кислоты. 276. После смешивания 100 м3 раствора хлорида кальция концентрацией 2 г/л и равного объема серной кислоты концентрацией 5 г/л. 277. После смешивания 5 м3 раствора хлорида бария концентрацией 1,5 % (плотность 1,5 г/см3) и 3 м3 серной кислоты концентрацией 2 % (плотность 1,012 г/см3). 278. После смешивания 5 г карбоната магния и 150 мл раствора азотной кислоты, концентрацией 4 % (плотность 1,01 г/см3). 279. После смешивания 1,5 л раствора гидроксида натрия концентрацией 4 г/л и 0,5 л гахзообразного хлороводорода (н.у.). 280. После смешивания 1,5 л 0,2 М раствора гидроксида кальция и 0,5 л углекислого газа (25°С, 1 атм.). 281. После смешивания 45 мл 0,3 н. раствора соляной кислоты и раствора, содержащий 0,32 г гидроксида натрия в 40 мл. 282. После смешивания одного литра раствора, содержащего 1,4 г гидроксида калия, и 60 мл 0,5 н. раствора серной кислоты. 283. После смешивания 1 л раствора азотной кислоты, содержащего 0,882 г кислоты и 40 мл 0,4 н. раствора гидроксида натрия. Прошла ли нейтрализация? 284. После смешивания 15 миллилитров 1 н. раствора едкого натра и 320 мл 0,1 М раствора серной кислоты. 285. После смешивания 20 мл раствора сульфата меди, в 1 л которого содержится 10 г меди, и 100 миллилитров 0,1 н. едкого натра (NaOH). 286. После смешивания 2 л раствора, содержащего 8,5 г гидроксида бария и 32 мл 10 % соляной кислоты плотностью 1,047 г/ см3. 287. После смешивания раствора гидроксида бария с концентрацией 100 г/л и 0,5 н. соляной кислоты в объемном отношении 1:2. 288. После смешивания 20 мл 0,2 н. раствора едкого кали и 13 мл 0,2 н. раствора кислоты. 289. После смешивания 20 мл 0,1 М раствора серной кислоты и 8 мл 0,5 н. раствора гидроксида натрия. 290. После смешивания 60 мл 0,2 н. раствора серной кислоты и раствора, содержащего 0,51 г гидроксида калия в 30 мл. 291. Хлороводород, образовавшийся при действии серной кислоты на 19 г безводного хлорида магния, пропустили в раствор объемом 500 мл, содержащий 10 г гидроксида калия. Найти рН полученного раствора. 292. После смешивания двух растворов объемом 0,5 л, содержащие 8,55 г нитрата свинца (II) и 3,75 г соляной кислоты. 293. Какое вещество, и в каком количестве останется в избытке в результате реакции между 14 г оксида кальция и 1 л раствора, содержащим 32 г азотной кислоты? Найти рН полученного раствора. Плотность раствора принять равной 1,02 г/см3. 294. Какое вещество, и в каком количестве останется в избытке в результате реакции между 4 г оксида магния и 10 г серной кислоты? Найти рН полученного раствора. Объем раствора серной кислоты – 0,5 л. Плотность раствора 1,01 г/см3. 295. Горячий KOH реагирует с хлором по реакции: 6 KOH + 3 Cl2 ® 5 KCl + KClO3 + 3 H2O. Найти рН раствора после поглощения 0,8 л хлора (7°С и 98,64 кПа) 0,1 М раствором гидроксида калия объемом 600 мл. 296. Сколько граммов гидроксида железа выпадет в осадок, если к 500 мл 0,2 н. раствора хлорида железа (III) (плотность 1,03 г/см3) добавить 5 г гидроксида натрия? Вычислить pH раствора после реакции. 297. После смешивания 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л. 298. Найти объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствора с рН = 4,03. 299. После смешивания 10 мл 6 % раствора соляной кислоты плотностью 1,03 г/см3 и 10 мл 1 % раствора гидроксида бария плотностью 1,0 г/см3. 300.. После смешивания 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 879; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.196.141 (0.009 с.) |

 ; (2.1)
; (2.1) . (2.2)
. (2.2) .
. , концентрация сульфат-ионов
, концентрация сульфат-ионов  .
. .
.


 .
.