Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Краткие теоретические сведенияСтр 1 из 7Следующая ⇒
Расчет ионной силы раствора Краткие теоретические сведения Чтобы не усложнять термодинамические соотношения, выведенные для идеальных растворов, Льюис предложил использовать в термодинамических соотношениях вместо концентрации активность. Активность компонента связана с его концентрацией в растворе через коэффициент активности g: Для растворов электролитов коэффициент активности связан с величиной ионной ассоциации. Чем сильнее ионная ассоциация в растворе, тем ниже коэффициент активности. Ионная ассоциация усиливается с ростом концентрации электролита в растворе и с увеличением заряда ионов. Если между ионами нет химического взаимодействия, то степень ассоциации ионов определяется ионной силой раствора. Ионной силой называют полусумму произведений моляльных концентраций всех ионов в растворе на квадраты их зарядов:
Чем выше ионная сила раствора, тем ниже коэффициент активности. При этом в растворах с одинаковой ионной силой среднеионные коэффициенты активности в первом приближении совпадают. В предельно разбавленном растворе ионная ассоциация отсутствует и коэффициент активности равен единице, т.е. активность равна концентрации. В рамках теории Дебая-Хюккеля для расчета среднеионного коэффициента активности вещества в водном растворе применяется одно из двух уравнений:
при ионной силе раствора менее 0,05 моль/кг и
при ионной силе раствора от 0,05 до 0,5 моль/кг, где Теория Дебая-Хюккеля предполагает возможность расчета коэффициента активности отдельного иона по уравнениям
при ионной силе раствора менее 0,05 моль/кг и
при ионной силе раствора от 0,05 до 0,5 моль/кг, где Примеры решения задач Пример 1. Вычислить ионную силу раствора сульфата натрия концентрацией 0,1 моль/кг и его среднеионный коэффициент активности. Решение. 1. Составить уравнение диссоциации соли:
2. Согласно уравнению диссоциации концентрация катионов натрия 3. Вычислить ионную силу раствора:
4. Вычислить среднеионный коэффициент активности сульфата натрия:
Задачи для решения 1. – 60. Вычислить ионную силу раствора заданной концентрации.
61. Для осаждения в виде хлорида всего серебра, содержащегося в 100 мл раствора нитрата серебра, потребовалось 50 мл 0,2 н. раствора соляной кислоты. Какова нормальность раствора нитрата серебра, какая масса хлорида серебра выпала в осадок? Найти ионную силу конечного раствора. 62. На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора серной кислоты. Чему равна нормальность раствора серной кислоты? Найти ионную силу раствора после смешения кислоты и щелочи. 63. Какой объем 0,3 н. раствора серной кислоты требуется для нейтрализации раствора содержащего 0,32 г гидроксида натрия в 40 мл? Найти ионную силу раствора после реакции. 64. На нейтрализацию одного литра раствора, содержащего 1,4 г гидроксида калия, требуется 50 мл раствора фосфорной кислоты. Вычислить нормальность раствора кислоты и ионную силу.
65. Какая масса азотной кислоты содержалась в 0,5 л раствора, если на нейтрализацию его потребовалось 35 мл 0,4 н. раствора гидроксида натрия? Вычислить ионную силу раствора после нейтрализации. 66. Сколько миллилитров 1 н. раствора едкого натра потребуется для полной нейтрализации 300 мл 0,1 М раствора серной кислоты? Вычислить ионную силу раствора после нейтрализации. 67. Сколько миллилитров 0,1 н. едкого натра (NaOH) потребуется для осаждения меди в виде гидроксида из 20 мл раствора сульфата меди, в 1 л которого содержится 10 г меди? Вычислить ионную силу раствора после реакции. 68. Сколько миллилитров 10 % соляной кислоты плотностью 1,047 г/ см3 потребуется для нейтрализации раствора, содержащего 8,5 г гидроксида бария? Вычислить ионную силу раствора после реакции. 69. Сколько миллилитров раствора соды, содержащего в 1 л 21,2 г соли, надо добавить к 30 мл 0,2 н. раствора хлорида кальция для полного осаждения кальция в виде карбоната? Вычислить ионную силу раствора после реакции. 70. Сколько граммов гидроксида железа выпадет в осадок, если к 500 мл 0,2 н. раствора хлорида железа (III) (плотность 1,03 г/см3) добавить 5 г гидроксида натрия? Вычислить ионную силу раствора после реакции. 71. В каком объемном отношении надо смешать растворы гидроксида бария с концентрацией 95,5 г/л и 0,5 н. соляной кислоты для получения раствора с нейтральной средой? Вычислить ионную силу раствора после реакции. 72. На нейтрализацию 20 мл раствора едкого кали потребовалось 13 мл 0,2 н. раствора соляной кислоты. Сколько граммов едкого кали содержится в 1 л раствора? Вычислить ионную силу раствора после реакции. 73. Сколько миллилитров раствора нитрата серебра, содержащего 5 г/л серебра, надо добавить к 10 мл 0,2 н. раствора хлорида натрия, чтобы полностью удалить из раствора ионы хлора? Вычислить ионную силу раствора после реакции. 74. Сколько миллилитров 2 н. серной кислоты потребуется для превращения 1,56 г гидроксида алюминия в сульфат алюминия? Вычислить ионную силу раствора после реакции. 75. Сколько граммов карбоната кальция можно растворить в 100 мл 20 % соляной кислоты плотностью 1,1 г/см3? Вычислить объем, который займет выделившийся газ при нормальных условиях и ионную силу полученного раствора. 76. К 5 г цинка прибавили 100 мл 10,2 % соляной кислоты (плотность раствора 1,05 г/см3). Какое вещество, и в каком количестве осталось в избытке? Вычислить объем выделившегося водорода при 20ºС и 750 мм рт. ст. и ионную силу полученного раствора. 77. На нейтрализацию 20 мл 5,66 % раствора гидроксида калия плотностью 1,053 г/см3 пошло 12,1 мл раствора серной кислоты плотностью 1,052 г/см3. Определить концентрацию (%) раствора серной кислоты и ионную силу конечного раствора. 78. Какое количество миллилитров 0,5 н. раствора сульфата натрия надо прилить к 100 мл 16 % раствора хлорида бария плотностью 1,156 г/см3, чтобы полностью осадить сульфат-ион? Определить ионную силу конечного раствора. 79. На нейтрализацию 50 мл раствора фосфорной кислоты плотностью 1,01 г/см3 израсходовано 31,2 г 1 н. раствора гидроксида натрия плотностью 1,04 г/см3. Определить концентрацию (%) фосфорной кислоты и ионную силу конечного раствора. 80. 10 г сплава меди с цинком обработали соляной кислотой (объем раствора 1,5 л, концентрация 0,02 н.). При этом выделилось 570 мл водорода, измеренных при температуре 27ºС и давлении 1 атм. Определить состав сплава и выразить его в массовых и мольных долях. Вычислить ионную силу раствора после реакции.
81. При растворении 15 г сплава серебра с алюминием раствором едкого натра объемом 0,5 л и концентрацией 1,25 г/л выделилось 13 мл водорода измеренного при температуре 57ºС и давлении 15×105 Па. Определить состав сплава и выразить его в массовых и мольных долях. Вычислить ионную силу раствора после реакции. 82. Растворили в 100 мл 0,05 н. азотной кислоты 5 г сплава меди и золота. При этом выделилось 0,99 мл оксида азота (II), измеренных при температуре 37ºС и давлении 1,2×105 Па. Определить состав сплава и выразить его в массовых и мольных долях. Вычислить ионную силу раствора после реакции. 83. Для нейтрализации 20 мл 0,1 н. раствора соляной кислоты потребовалось 8 мл раствора гидроксида натрия. Сколько граммов NaOH содержит 1 л этого раствора? Вычислить ионную силу раствора после реакции. 84. Какой объем 0,2 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,51 г гидроксида калия в 30 мл? Вычислить ионную силу раствора после реакции. 85. Сколько и какого вещества останется в избытке, если к 150 мл 0,4 н. раствора соляной кислоты прибавить 250 мл 0,2 н. раствора гидроксида натрия? Вычислить ионную силу раствора после реакции. 86. Определить эквивалентную массу кислоты, если на нейтрализацию раствора, содержащего 0,63 г кислоты, израсходовано 20 мл 0,5 н. раствора щелочи. Вычислить ионную силу раствора щелочи. 87. На нейтрализацию раствора, содержащего 4,05 г кислоты, израсходовано 40 мл раствора едкого натра (NaOH) концентрацией 10 % плотностью 1,109 г/см3. Определить эквивалентную массу кислоты. Вычислить ионную силу раствора щелочи. 88. К 50 л раствора фосфорной кислоты концентрацией 8 % плотностью 1,042 г/см3 прибавили 2 л фосфата натрия концентрацией 5 г/л. Рассчитать молярную концентрацию фосфат-иона в полученном растворе и его ионную силу. 89. На нейтрализацию 10 мл раствора серной кислоты концентрацией 22 % плотностью 1,155 г/см3 потребовалось 50 мл раствора щелочи концентрацией 41,6 г/л. Определить из этих данных эквивалентную массу щелочи и ионную силу конечного раствора. 90. Смешали 4 мл серной кислоты концентрацией 40 % (плотность 1,303 г/см3) и 200 мл серной кислоты, концентрацией 0,001 моль/л. Рассчитать нормальную концентрацию и ионную силу полученного раствора.
91. Смешали 8 л раствора соляной кислоты концентрацией 4 моль/л и 11 л раствора ее же концентрацией 2 г/л. Рассчитать концентрацию полученного раствора (г/л) и его ионную силу. 92. К 1,2 л 1,8 н. раствора сульфата хрома (III) добавили 3 л 1 % раствора гидроксида аммония (плотность равна 1 г/см3). Рассчитать ионную силу полученного раствора. 93. К раствору объемом 30 мл, содержащему 10 г серной кислоты в 100 мл раствора, прибавили 40 мл раствора NaOH, содержащего 9 г гидроксида натрия в 100 мл раствора. Найти молярную концентрацию того вещества, которое останется в избытке и ионную силу полученного раствора. 94. Смешали раствор нитрата серебра, концентрацией 1 % плотностью 1,01 г/см3 и раствор соляной кислоты концентрацией 5 % (плотность 1,02 г/см3) в соотношении 3:4. Рассчитать молярную концентрацию нитрат-иона в полученном растворе и ионную силу полученного раствора. 95. Какой объем раствора серной кислоты концентрацией 10 % (плотность 1,07 г/см3) потребуется для полной нейтрализации 0,5 л раствора NaOH концентрацией 16 г/л? Вычислить ионную силу конечного раствора. 96. Смешали 10 мл раствора HCl концентрацией 10 % (плотность 1,047 г/см3) и 10 мл раствора HCl концентрацией 6 % (плотность 1,028 г/см3). Рассчитать массовую долю и молярную концентрацию соляной кислоты в полученном растворе и его ионную силу. 97. Из раствора нитрата серебра концентрацией 2 % (плотность 1,015 г/см3) по реакции с хлоридом натрия образуется 14,35 г. хлорида серебра. Вычислить исходный объем раствора нитрата серебра и ионную силу конечного раствора. 98. Сколько миллилитров 0,5 н. раствора сульфата натрия нужно прилить к 100 мл раствора хлорида бария концентрацией 16 % (плотность 1,156 г/см3), чтобы полностью осадить сульфат-ионы? Найти ионную силу конечного раствора. 99. Металл вытеснил из 100 мл соляной кислоты 348 мл водорода, измеренного при 20°С и 99,5 кПа. Рассчитать нормальную концентрацию хлорида металла в полученном растворе и его ионную силу. 100. К 30 мл горячего 10 %-ного водного раствора сульфата алюминия (плотность 1,1 г/см3) прилили 20 мл горячего 10 %-ного водного раствора карбоната натрия (плотность 1,15 г/см3). Смесь оставили на сутки на воздухе. Определить ионную силу конечного раствора. 101. К 20 мл горячего 20 %-ного водного раствора хлорида хрома (плотность 1,1 г/см3) прилили 20 мл горячего 10 %-ного водного раствора сульфида натрия (плотность 1,15 г/см3). Смесь оставили на сутки. Определите ионную силу конечного раствора. 102. К 20 мл горячего 20 %-ного водного раствора хлорида железа (III) (плотность 1,2 г/см3) прилили 15 мл горячего 20 %-ного водного раствора силиката натрия (плотность 1,2 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора. 103. К 40 мл горячего 10 %-ного водного раствора сульфата хрома (III) (плотность 1,1 г/см3) прилили 10 мл горячего 20 %-ного водного раствора карбоната натрия (плотность 1,2 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора. 104. К 25 мл горячего 10 %-ного водного раствора сульфата железа (III) (плотность 1,1 г/см3) прилили 20 мл горячего 20 %-ного водного раствора карбоната натрия (плотность 1,2 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора.
105. К 30 мл горячего 10 %-ного водного раствора сульфата алюминия (плотность 1,1 г/см3) прилили 20 мл горячего 10 %-ного водного раствора сульфида натрия (плотность 1,15 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора. 106. К 20 мл горячего 20 %-ного водного раствора хлорида хрома (III) (плотность 1,1 г/см3) прилили 20 мл горячего 10 %-ного водного раствора карбоната натрия (плотность 1,15 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора. 107. К 20 мл горячего 20 %-ного водного раствора хлорида хрома (III) (плотность 1,1 г/см3) прилили 20 мл горячего 10 %-ного водного раствора силиката натрия (плотность 1,2 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора. 108. К 20 мл горячего 20 %-ного водного раствора хлорида железа (III) (плотность 1,2 г/см3) прилили 20 мл горячего 10 %-ного водного раствора сульфида натрия (плотность 1,15 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора. 109. К 40 мл горячего 10 %-ного водного раствора сульфата алюминия (плотность 1,1 г/см3) прилили 20 мл горячего 20 %-ного водного раствора силиката натрия (плотность 1,2 г/см3). Смесь оставили на сутки на воздухе. Определите ионную силу конечного раствора. 110. В раствор, содержащий нитрат калия, нитрат серебра и нитрат меди (II) массой 250 г поместили железные опилки, массой 1,25 г. Какие металлы и в каком количестве выделятся из раствора, если содержание солей металлов в исходном растворе следующее: нитрат калия 0,5 %, нитрат меди 0,94 %, нитрат серебра 1,021 %? Вычислить ионную силу конечного раствора. 111. К 20 мл 0,1 М раствора нитрата свинца (II) прилили 20 мл 0,15 н. раствора иодида калия. Найти массу образовавшегося осадка и вычислить ионную силу конечного раствора. 112. К 200 мл раствора, содержащего 0,3 г сульфида калия прибавили 300 мл 0,1 % раствора серной кислоты (плотность – 1,0 г/см3). Найти объем выделившегося газа (Т = 25°С, Р = 1 атм.) и ионную силу конечного раствора. 113. Смешали 200 мл 4 % раствора сульфата меди (II) (плотность 1,04 г/см3) и 400 мл 1 % раствора гидроксида натрия (плотностью 1 г/см3). Определить массу осада и ионную силу конечного раствора. 114. 5 г карбоната кальция растворили в 150 мл 4 % соляной кислоты (плотность 1,02 г/см3). Найти объем выделившегося углекислого газа и ионную силу конечного раствора. 115. Смешали 200 мл 0,1 н. раствора бромида алюминия и 120 мл 0,15 н. раствора нитрата серебра. Определить ионную силу конечного раствора и массу образовавшегося осадка. 116. К 5 г судбфида натрия прилили 500 мл 0,1 н. раствора серной кислоты. Определить объем сероводорода и ионную силу конечного раствора. 117. К 50 мл 1,5 % раствора гидроксида бария (плотность 1,008 г/см3) прилили 300 мл 2 % раствора соляной кислоты (плотность 1,01 г/см3). Вычислить ионную силу конечного раствора. 118. 1,546 г гидроксида железа (III) растворили в 300 мл азотной кислоты, концентрацией 10,5 г/л. Определить концентрацию нитрата железа (III) в полученом растворе и ионную силу этого раствора. 119. Смешали растворы хлорида железа (III) и гидроксида калия в объемном соотношении 1:1 (по 2 литра) и одинаковой концентрацией 1 г/л. Определить ионную силу полученного раствора. 120. К 150 мл 0,1 н. нитрата бария прилили 100 мл 0,1 н. раствора сульфата натрия. Определить массу сульфата бария и ионную силу получившегося раствора. Пример 4. Вычислить рН раствора серной кислоты концентрацией 0,005 моль/кг в воде и в растворе хлорида алюминия концентрацией 0,005 моль/кг. Решение. 1. Составить уравнение диссоциации серной кислоты:
2. Согласно уравнению диссоциации концентрация катионов водорода 3. Оценить рН раствора по концентрации катионов водорода:
4. Вычислить ионную силу раствора:
5. Вычислить значение коэффициента активности катионов водорода:
6. Вычислить значение активности катионов водорода в растворе серной кислоты:
7. Вычислить значение рН:
8. Вычислить ионную силу раствора, содержащего серную кислоту и хлорид алюминия
9. Вычислить коэффициент активности катионов водорода
10. Вычислить рН раствора серной кислоты в присутствии хлорида алюминия
Вывод: увеличение ионной силы раствора приводит к снижению активности катионов водорода и снижению рН.
Задачи для решения I. Вычислить рН раствора сильного электролита в воде и в присутствии индифферентного электролита
II. Вычислить рН конечного раствора при смешении электролитов. Плотность раствора принять равной 1.
III. Вычислить рН раствора по приведенным ниже данным. 241. После выщелачивания боксита по следующим данным: масса руды 1 т; ω(Al2O3∙Н2O) = 80 %; V (NaOH)=3,1 м3; ω(NaOH)=15 %. 242. Если к 20 л раствора соляной кислоты концентрацией 10 % (d = 1,047 г/мл) было добавлено 5 м3 раствора гидроксида кальция концентрацией 0,02 экв/л. 243. Содержащего 4 г KOH и 5 г NaOH в одном литре воды. 244. Содержащего 0,005 моль/л серной кислоты и 0,006 моль/л соляной кислоты. 245. После выщелачивания руды по следующим данным: масса руды = 1 т; ω(Li2O∙Al2O3∙4SiO2)=70 %; V (H2SO4)=4 м3; ω(H2SO4)=5% (d =1,032 г/мл); уравнение реакции: Li2O∙Al2O3∙4SiO2 + H2SO4 = Li2SO4 + Al2O3∙4SiO2∙H2O↓. 246. После выщелачивания руды при следующих условиях: масса руды – 1 т, в ней содержится 6 % Cu4(SO4)(OH)6; ω(H2SO4)=3 %, d =1,03 г/мл, V (H2SO4)=3 м3. 247. Полученного при разбавлении 20 л 10 % соляной кислоты (d =1,047 г/мл) пятью кубометрами воды. 248. Азотнокислых стоков, если 10 л 5 % азотной кислоты сброшены в резервуар с водой емкостью 5 м3. 249. 10 м3 раствора, содержащего по 50 г серной и дихромовой кислот. 250. Содержашего дихромовую кислоту (2 мг/мл Cr (VI)) и азотную кислоту (1 мг/мл). 251. После смешивания 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л. 252. Найти объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствора с рН = 4,03. 253. После смешивания 2 л серной кислоты концентрацией 0,01 моль/л и 3 л щелочи с рН=12,5. 254. После смешивания 0,2 л 0,5 н. HCl и 0,3 л 0,3 М NaOH. 255. После смешивания 200 мл 0,5 н. раствора серной кислоты и 300 мл раствора едкого натра с концентрацией 0,3 моль/л. 256. После смешивания 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты. 257. После смешивания 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария. 258. После смешивания 100 мл 0,2 % раствора едкого натра (NaOH) и 200 мл 0,1 % раствора NaOH. 259. После смешивания 200 мл 0,7 н. раствора серной кислоты и 3000 г воды. 260. После смешивания 54 мл 0,5 % раствора NaOH и 10 мл 0,2 % раствора NaOH. 261. После смешивания 500 мл 0,3 % раствора КОН и 500 мл воды? 262. После смешивания 4 мл 0,46 % серной кислоты и 200 мл серной кислоты, концентрацией 0,001 моль/л. 263. После смешивания 8 л раствора соляной кислоты концентрацией 0,04 моль/л и 11 л раствора ее же концентрацией 2 г/л. 264. После смешивания 30 мл раствора, содержащего 0,109 г серной кислоты в 100 мл раствора, и 40 мл раствора NaOH, содержащего 0,098 г гидроксида натрия в 100 мл раствора. 265. После смешивания 10 мл 0,12 % раствора HCl и 10 мл 0,076 % раствора HCl. 266. После смешивания 10 мл 6 % раствора соляной кислоты плотностью 1,03 г/см3 и 10 мл 1 % раствора гидроксида бария плотностью 1,0 г/см3. 267. После смешивания 31 мл 0,16 н. раствора щелочи и 317 мл 0,02 н. раствора серной кислоты. 268. После смешивания 150 мл 0,4 н. раствора соляной кислоты и 250 мл 0,2 н. раствора гидроксида натрия. 269. После смешивания 4 мл серной кислоты концентрацией 40 % (плотность 1,303 г/см3) и 200 мл серной кислоты, концентрацией 0,001 моль/л. 270. После смешивания 8 л раствора соляной кислоты концентрацией 4 моль/л и 11 л раствора ее же концентрацией 2 г/л. 271. После смешивания 30 мл раствора, содержащему 10 г серной кислоты в 100 мл раствора, и 40 мл раствора NaOH, содержащего 9 г гидроксида натрия в 100 мл раствора. 272. После смешивания 500 мл раствора силиката натрия концентрацией 11 г/л и 500 мл раствора серной кислоты концентрацией 4,6 г/л. Дополнительно определить массу оксида кремния. 273. После смешивания 500 мл раствора гидроксида бария концентрацией 1,5 % (плотность 1,008 г/см3) и 300 мл 2 % раствора серной кислоты (плотность 1,012 г/см3). 274. После смешивания 500 мл 4 % раствора гидроксида натрия (плотность 1,043 г/см3) и 30 мл 2 % раствора серной кислоты (плотность 1,012 г/см3).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 444; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.129.100 (0.123 с.) |
 .
. . (1.1)
. (1.1) (1.2)
(1.2) (1.3)
(1.3) и
и  – заряд катиона и аниона.
– заряд катиона и аниона. (1.4)
(1.4) (1.5)
(1.5) – заряд отдельного иона.
– заряд отдельного иона. .
. , концентрация сульфат-ионов
, концентрация сульфат-ионов  .
.
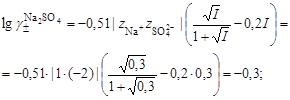
 .
. .
. , концентрация сульфат-ионов
, концентрация сульфат-ионов  .
. .
.


 .
.