Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесия в растворах слабых кислот и основанийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Расчет рН в растворах слабых кислот и оснований Слабые кислоты и основания в водных растворах диссоциированы не полностью и основная масса вещества существует в растворе в молекулярной форме. Процесс диссоциации слабого электролита протекает ступенчато. Например, для слабой двухосновной кислоты H2An:
Основной количественной характеристикой силы слабого электролита является константа равновесия процесса диссоциации или константа диссоциации. Каждая ступень диссоциации характеризуется своей константой равновесия. Для слабой двухосновной кислоты H2An существует две константы диссоциации:
Значения констант диссоциации для 25°С приводятся в справочной литературе Обычно константа диссоциации по второй ступени приближенно в 104-105 раз ниже, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН в растворах многоосновных слабых кислот обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями.
где Пример 11. Вычислить рН раствора гидроксида аммония концентрацией 0,5 моль/л; Решение. 1. Записать уравнение диссоциации гидроксида аммония
2. Вычислить концентрацию гидроксид-ионов в растворе аммиака в воде
и величину рН (полагая
Задачи для решения IV. Определить pH предложенного раствора слабого электролита при температуре 25°
Расчет рН в растворе гидролизующейся соли рН в растворе гидролизующейся соли определяется природой слабого электролита. При гидролизе соли, образованной сильным основанием и слабой кислотой, гидролизуется анион слабой кислоты. В растворе появляются ионы ОН-, поэтому среда щелочная, рН > 7.
Если соль, образована слабым основанием и сильной кислотой, то гидролизуется катион слабого основания:
в растворе появляются ионы Н+, поэтому среда кислая, рН < 7. Гидролиз является обратимым процессом и имеет ступенчатый характер. Термодинамической характеристикой гидролиза является его константа равновесия – константа гидролиза. Константу гидролиза проще всего вычислить через значение константы диссоциации слабого электролита по уравнению:
Первой константе гидролиза соответствует последняя константа диссоциации, последней константе гидролиза – первая константа диссоциации, в чем нетрудно убедиться, сравнивая состав (по кислотным остаткам) реакций диссоциации и гидролиза для фосфорной кислоты:
Обычно константа гидролиза по второй ступени во много раз меньше, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН обычно учитывают только первую ступень гидролиза, пренебрегая последующими его ступенями. Ионная сила раствора гидролизующейся соли в этом случае может быть вычислена без учета реакции гидролиза по концентрации соли. В случае гидролиза по аниону (2.17) константа равновесия запишется следующим образом:
где Концентрация ионов
где Сi – моляльная концентрация гидролизующегося иона. При гидролизе по катиону (2.18) константа равновесия запишется следующим образом:
где Концентрация катионов водорода вычисляется по уравнению:
Пример 14. Вычислить рН раствора сульфата аммония концентрацией 3 % при 25°С; Решение. 1. Вычислить моляльную концентрацию сульфата аммония
2. Вычислить ионную силу раствора, используя концентрацию соли
3. Составить ионное уравнение гидролиза сульфата аммония:
4. Составить уравнение константы гидролиза
5. Вычислить константу гидролиза
6. Вычислить концентрацию катионов водорода
7. Рассчитать коэффициент активности катионов водорода
8. Вычислить рН раствора
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 1708; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.01 с.) |

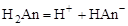 – первая ступень диссоциации;
– первая ступень диссоциации; – вторая ступень диссоциации.
– вторая ступень диссоциации.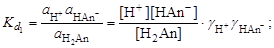
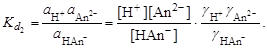
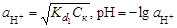 и (2.15)
и (2.15)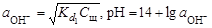 , (2.16)
, (2.16)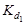 – первая константа диссоциации слабого электролита, С к и С щ - молярные концентрации кислоты и, соответственно, щелочи.
– первая константа диссоциации слабого электролита, С к и С щ - молярные концентрации кислоты и, соответственно, щелочи.
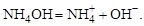
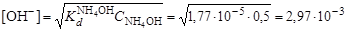
 )
)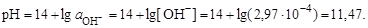
 , (2.17)
, (2.17)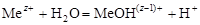 , (2.18)
, (2.18)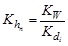 , (2.19)
, (2.19)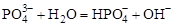

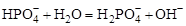

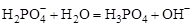
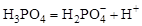
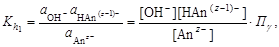 (2.24)
(2.24)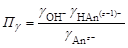 – произведение коэффициентов активности.
– произведение коэффициентов активности.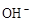 вычисляется по уравнению:
вычисляется по уравнению: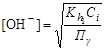 , (2.25)
, (2.25)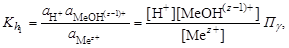 (2.26)
(2.26)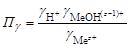 – произведение коэффициентов активности.
– произведение коэффициентов активности.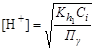 . (2.27)
. (2.27)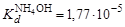 .
.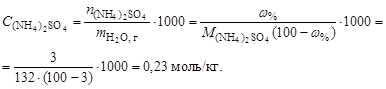



 и
и  .
.