
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидролиз соли BaS, образованной сильным основанием и слабой кислотой.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Соль ВаS образована сильным основанием Ba(OH)2 и слабой кислотой H2S (см. приложение), следовательно, будет подвергаться гидролизу по слабому аниону S2–, а поскольку заряд аниона серы равен Далее необходимо убедиться, что соль, гидролиз который вы будете расписывать, растворима в воде (см. таблицу растворимости в приложении 5). Условно считают, что все хорошо растворимые соли являются сильными электролитами и, следовательно, диссоциируют практически полностью на ионы: BaS → Ва+2 + S2–. Записываем 1-ю ступень гидролиза при взаимодействии аниона серы с молекулой воды: краткое ионно-молекулярное уравнение: S2– + HOH ↔ HS– + OH–; полное ионно-молекулярное уравнение: S2– + Ba2+ + HOH ↔ Ba2+ + HS– + OH-; молекулярное уравнение: 2BaS + 2H2O ↔ Ba(HS)2 + Ba(OH)2. 2-я ступень гидролиза: краткое ионно-молекулярное уравнение: HS– + HOH ↔ H2S + OH–; полное ионно-молекулярное уравнение: 2HS– + Ba2+ + 2H2O ↔ Ba2+ + 2H2S + 2OH–; молекулярное уравнение: Ba(HS)2 + 2H2O ↔ 2H2S + Ba(OH)2. Итак, в результате гидролиза появляются несвязанные ОН–, следовательно, среда в растворе соли должна быть щелочной. Количественной характеристикой гидролиза солей служит константа гидролиза, которую записывают на основании краткого ионного уравнения 1-й ступени гидролиза:
Один из множителей в знаменателе (концентрация воды) практически не меняется при изменении концентрации соли, вследствие чего ее условно можно считать величиной постоянной. Умножив правую и левую части уравнения для константы равновесия на величину [H2O], получаем K гидролиза для первой ступени:
Из уравнения ионного произведения воды K w = [H+] [OH–] выразим [OH–]:
Для того чтобы понять, что представляет величина 1-я ступень Н2S ↔ H+ + HS– K а(1-ой ступени) = 2-я ступень HS- ↔ H+ + S2– K а(2-ой ступени) = Очевидно, что
Следовательно,
Вычислим pH раствораBaS, если аналитическая концентрация соли С (BaS) = 0,01 моль/л. Прежде всего найдем константу гидролиза K г (1-й ступени), для этого воспользуемся значением константы диссоциации сероводородной кислоты K а2 = 1·10–12 (см. приложение 11) и ионное произведение воды K w = 10–14: K г (1-й ступени) = K w / K а2 = 10-–14 /1·10–12 = 10–2. Теперь найдем степень гидролиза: Для вычисления pH следует принять во внимание, что в результате гидролиза каждого аниона S2– образуется один гидроксид-ион OH–. Если исходная концентрация гидролизующихся анионов равна С, моль/л, а гидролизу подверглась доля β этих анионов, то при этом образовалось β× С моль/л ионов OH–. Таким образом, [OH–] = β· С BaS = 1 · 0,01 = 0,01 моль/л. Следовательно, рOH = –lg [OH-] = –lg 0,01 = 2. Учитывая, что: рH + рOH = 14 рH = 14 – рOH = 14 – 2 = 12. Таким образом, выполненные расчеты подтвердили, что соль BaS имеет щелочную реакцию среды. 2. Гидролиз соли СuCl2, образованной слабым основанием и сильной кислотой. Анионы хлора не принимают участия в реакциях, поскольку не образуют с водой слабого электролита. Так как заряд катиона меди равен «2+», то стадий гидролиза будет также две. Водный раствор будет иметь кислую реакцию, так как взаимодействие ионов слабого основания Сu2+ с водой приведет к смещению равновесия диссоциации воды и к образованию свободных протонов водорода. 1-я стадия гидролиза: краткое ионно-молекулярное уравнение: Сu2++HOH ↔ CuOH++H+; полное ионно-молекулярное уравнение: Сu2+ + 2Cl– + H2O ↔ CuOH+ + H+ + 2Cl–; молекулярное уравнение: CuCl2 + H2O ↔ CuOHCl + HCl. 2-я стадия гидролиза: краткое ионно-молекулярное уравнение: СuOH+ + HOH ↔ Cu(OH)2 + H+; полное ионно-молекулярное уравнение: СuOH+ + Cl– + HOH ↔ Cu(OH)2 + H+ + Cl–; молекулярное уравнение: CuOHCl + H2O ↔ Cu(OH)2 + HCl. Запишем выражение для константы равновесия процесса гидролиза по второй стадии исходя из краткого ионного уравнения:
Поскольку концентрация воды – величина практически постоянная, то умножив константу равновесия на величину [H2O], получаем K гидр по 2-й ступени = Из ионного произведения воды K w = [H+] [OH–] выразим концентрацию [H+]:
Для того чтобы понять, что представляет величина
1-я ступень: Сu(OH)2 ↔ CuOH+ + OH– K b(1-й ступени) = 2-я ступень: CuOH+ ↔ Cu 2+ + OH– K b(2-й ступени) = Очевидно, что Следовательно,
Кислую реакцию среды соли CuCl2 подтвердим расчетами, т.е. определим pH раствора, зная, что С (CuCl2) = 0,001 моль/л. Прежде всего найдем константу гидролиза K г2, для этого воспользуемся значением константы диссоциации меди гидроксида (K b1 = K г2 = K w / K b1 = 10–14 /(3,4·10–7) = 2,9·10–8. Теперь найдем степень гидролиза β:
Для вычисления pH следует принять во внимание, что в результате гидролиза каждого катиона Cu2+ образуется один ион H+. Если исходная концентрация гидролизующихся катионов была С моль/л, а гидролизу подверглась доля β этих катионов, то при этом образовалось β С моль/л ионов H+. Таким образом, [H+] = β С BaS = 5,38·10–3·0,001= 5,38·10–6 моль/л. Следовательно, рH = –lg [H+] = –lg 5,38·10–6 = 5,26. Выполненные расчеты подтвердили, что соль CuCl2имеет кислую реакцию среды. 3. Гидролиз соли СН3СOONН4, образованной слабым основанием и слабой кислотой. В процессе гидролиза солей, образованных слабыми основаниями и слабыми кислотами, принимают участие оба иона. Гидролиз идет необратимо и до конца. Водный раствор имеет реакцию, близкую к нейтральной, так как образующиеся в результате уксусная кислота и гидроксид аммония – электролиты почти равной силы. Ионно-молекулярное уравнение: СН3СОО– + NH4+ + HOH → CH3COOH + NH4OH. Молекулярное уравнение: СН3СООNH4 + H2O → CH3COOH + NH4OH;
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1900; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.13.192 (0.01 с.) |

 .
.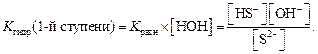
 и подставим в уравнение K гидр (1-й ступени);
и подставим в уравнение K гидр (1-й ступени);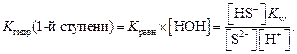
 , запишем постадийно уравнения диссоциации сероводородной кислоты Н2S и выражения для ее констант диссоциации K а для 1-й и 2-й ступени (символ «а» в подстрочном индексе константы – это сокращение от англ. «acid» – кислота):
, запишем постадийно уравнения диссоциации сероводородной кислоты Н2S и выражения для ее констант диссоциации K а для 1-й и 2-й ступени (символ «а» в подстрочном индексе константы – это сокращение от англ. «acid» – кислота): ;
;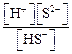 .
. .
. .
. .
.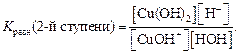

 и подставим в уравнение K гидр по 2-й ступени:
и подставим в уравнение K гидр по 2-й ступени: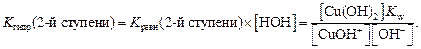
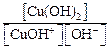 , напишем ступенчатую диссоциацию основания и выражения для констант диссоциации по 1- и 2-й ступени (символ «b» в подстрочном индексе константы – это сокращение от англ. «basic» – основание):
, напишем ступенчатую диссоциацию основания и выражения для констант диссоциации по 1- и 2-й ступени (символ «b» в подстрочном индексе константы – это сокращение от англ. «basic» – основание):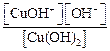 .
.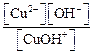 .
.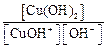 есть не что иное, как
есть не что иное, как 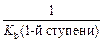
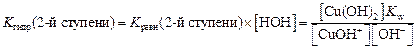 =
=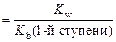 .
.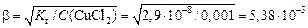 .
.



