
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз расплавов солей и основанийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При электролизе расплавов на катоде всегда восстанавливаются катионы металла: К(–): Ме n + + n ē → Me0. Анодный процесс определяется составом аниона: а) если анион бескислородной кислоты (Cl–, Br–, I–, S2–), то анодному окислению подвергается этот анион, и образуется простое вещество: A(+): 2Cl– – 2ē → Cl2↑ или A(+): S2– – 2ē → S0; б) если анодному окислению подвергается кислородсодержащий анион (SO42–, SiO32–, HO– и др.), то при этом неметалл образует оксид (без изменения своей степени окисления), и выделяется кислород: A(+): 2SiO32– – 4ē → 2SiO2 + О2 A(+): 2SO32– – 4ē → 2SO2 + О2 A(+): 4РO43– – 12ē → 2Р2O5 + 3О2 A(+): 4NO3– – 4ē → 2N2O5 + О2 A(+): 4HO– – 4ē → 2H2O + О2 Пример 1. Расплав соли ZnCl2 ZnCl2 ® Zn2+ + 2Cl–
Электролиз растворов солей При электролизе водных растворов следует учитывать, что окислительно-восстановительным процессам подвергаются не только ионы соли, но и вода. Возникает конкуренция частиц. Осуществляться будет тот процесс, который требует минимума энергии. Это значит, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. Катодные процессы определяются электрохимической активностью катиона соли. Чем левее находится металл в ряду напряжения, тем труднее его катионы восстанавливаются на катоде:
I группа II группа III группа Для катионов металлов до Al включительно (I группа) катодный процесс – это восстановление водорода из воды: (–)К: 2Н2О + 2ē → Н2 + 2НО–. Для катионов металлов, стоящих в ряду напряжения от Mn до Н2 (–) К: Также следует учесть, что если соль образована слабым основанием и сильной кислотой, то до процесса электролиза эта соль подвергнется гидролизу, в результате которого среда станет кислой, следовательно, в растворе появятся свободные протоны водорода Н+, и тогда будут конкурировать два процесса: (–) К: Какой из этих процессов будет превалирующим, зависит от ряда факторов: активности Ме, рН раствора, концентрации соли, приложенного напряжения и условий электролиза.
Для катионов металлов после водорода (III группа) катодный процесс – это восстановление их до металла: (–) К: Ме n + + n ē → Me0. Анодные процессы зависят и от электролита, и от материала анода. 1. В зависимости от материала анода различают электролиз с растворимым и нерастворимым анодом. Нерастворимый (или инертный) анод не принимает химического участия в анодном процессе. К таким электродам относятся аноды из Pt и угольные аноды. Растворимый (активный) анод сам подвергается окислению. К растворимым анодам относятся все металлические электроды: Me → Me n + + n ē 2. Исходя из состава анионов солей: а) если анион бескислородной кислоты (Cl–, Br–, I–, S2– и др.), то окисляется он до простых веществ (за исключением F–): A(+): S2– – 2ē → S0; б) при наличии кислородсодержащего аниона (SO42–, CO32– и т.д. или OH–) анодному окислению подвергается только вода: A(+): 2H2O – 4ē → O2 + 4H+. Законы Фарадея Законы Фарадея являются количественными законами электролиза. Первый закон Фарадея. Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через раствор электричества: m г = K Q кл Q кл = I А t с. Второй закон Фарадея. Массы различных веществ, выделяемых или растворяемых одним и тем же количеством электричества, пропорциональны молярным массам их химических эквивалентов.
где m – масса восстановленного или окисленного вещества, г; t – время электролиза, с; Мэкв – молярная масса эквивалентов; F – постоянная Фарадея, 96500 кулонов/моль. Следует помнить, что Мэкв = М/ n, где Если потенциалы двух или нескольких электродных реакций равны, то эти реакции протекают на электроде одновременно. При этом прошедшее через электрод электричество расходуется на эти реакции. Доля количества электричества, расходуемая на превращение одного из веществ (B j), называется выходом по току этого вещества: B j (%) = Qj ∙ 100%/ Q, где Qj – количество электричества, израсходованного на превращение
Обучающие задачи Задача 1. Составьте уравнения электродных процессов, протекающих при электролизе расплава: а) щелочи гидроксида натрия (NaOH) и б) соли нитрата цинка Zn(NO3)2. Решение. расплав щелочи NaOH подвергается диссоциации: NaOH ® Na+ + OH–
Суммарное уравнение электролиза получают сложением правых и левых частей уравнений при условии равенства электронов, принимающих участие в катодном и анодном процессах.
К А б) Расплав соли Zn(NO3)2 подвергается диссоциаиции: Zn(NO3)2 ® Zn2+ + 2NO3–
К А Задача 2. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора СoCl2 в электролизере с угольными электродами. Решение. Запишем уравнение диссоциации соли: CоCl2 ® Cо2+ + 2Cl– Ионы Cо2+ под действием электрического тока движутся к отрицательно заряженному катоду. Для катионов металлов, стоящих в ряду напряжения от Mn до Н2 (II группа), куда входит кобальт, идут параллельно конкурентные процессы восстановления катионов металлов и водорода из воды: (–) К: К положительно заряженному аноду движутся анионы Cl– и полярные молекулы воды. Если анион бескислородной кислоты (Cl–, Br–, I–, S2– и др.), то окисляется он до простых веществ: A(+): 2Cl– – 2e– ® Cl2. Задача 3. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора K2SO4 в электролизерах: а) с угольными электродами; б) с цинковыми электродами. Для каждого варианта вычислите массы (или объемы) веществ, полученных (или растворенных) на электродах, если через электролизеры пропущен ток силой 10 А в течение 1 ч 10 мин. Решение а) Электролиз на угольных электродах. Запишем уравнение диссоциации соли: K2SO4 ® 2K+ + SO42–. Ион Na+ под действием электрического тока движется к отрицательно заряженному катоду. Для катионов металлов до Al включительно (–)К: 2Н2О + 2ē → Н2 + 2НО–. К положительно заряженному аноду движутся анионы SO42– и полярные молекулы воды. Если анион кислородсодержащий, как сульфат анион, то анодному окислению подвергается только вода: A(+): 2H2O – 4ē → O2 + 4H+. По законам Фарадея объем восстановленного на катоде водорода:
где V экв = Vm / n (Vm = 22,4 л/моль – объем 1 моль газа при н.у., n – число отданных или принятых электронов), V экв = 22,4/2 = 11,2 л/моль; I А – сила тока, А; t – продолжительность электролиза, с; F – постоянная Фарадея, 96500 Кл/моль.
Рассчитаем объем кислорода, выделившегося на аноде: так как n = 4 (см. электродную реакцию), то V экв = 22,4/4 = 5,6 л/моль:
б) В случае, если электролиз проводится с цинковым электродом, который является растворимым (сам подвергается окислению), процессы на катоде не изменятся, а на аноде будет окисляться цинк. K2SO4 ® 2K+ + SO42– (–)К: 2Н2О + 2ē → Н2 + 2НО– (+) А: Zn0 – 2ē → Zn2+ Объем восстановленного на катоде водорода определяется, как и в предыдущем случае, а масса растворенного на аноде цинка находится по законам Фарадея:
где Мэкв = М/ n, где М – молярная масса; n – число принимаемых или отдаваемых в реакции электронов, Мэкв (Zn) = 65/2 = 32,5 г/моль;
Задача 4. В течение какого времени следует проводить электролиз при силе тока 8 А для выделения на катоде всего серебра, содержащегося в 250 мл 0,1 М раствора AgNO3?
Решение В водном растворе соль подвергается диссоциации: AgNO3 ®Ag+ + + NO3–. Ион Ag+ под действием электрического тока движется к отрицательно заряженному катоду. Для катионов металлов, стоящих правее водорода (III группа), куда входит серебро, катодный процесс – это восстановление до металла: К(–): Ag+ + 1 ē ® Ag0. К положительно заряженному аноду движутся анионы NO3– и полярные молекулы воды. Так как анион кислородсодержащий, то анодному окислению подвергается только вода: A(+): 2H2O – 4ē → O2 + По законам Фарадея:
m Ag = c · V · MAg = 0,1 моль/л· 0,25л · 108 г/моль = 2,7 г.; Мэкв Ag = 108/2 = 54 г/моль;
Задача 5. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора NaNO2. Укажите реакцию среды раствора (рН) до электролиза и изменение рН у анода и катода в процессе электролиза. Рассчитайте массы веществ, выделившихся при электролизе за 10 мин на графитовых электродах, при силе тока 6 А. Катодный выход по току 90 %, а анодный – 70 %. Решение. Соль диссоциирует в водном растворе по уравнению: NaNO2 → Na+ + NO2– К(–): 2H2O + 2ē ® H2 + 2OH– A(+):2H2O – 4ē ® O2 + 4H+ Для того чтобы определить рН до электролиза, необходимо написать гидролиз соли в ионно-молекулярном виде, учитывая, что соль образована сильным основанием и слабой кислотой: NO2–+ HOH ↔ HNO2 + OH–, отсюда видно, что в растворе накапливаются ионы OH–, следовательно, среда должна быть щелочной, рН >7. После электролиза на катоде накапливаются также ОН– ионы, следовательно, среда станет более щелочной, рН >>7, а на аноде вследствие накопления ионов Н+ рН начнет понижаться и будет стремиться к нейтральной среде, рН ® 7. По закону Фарадея:
где Вj – выход по току в долях; Мэкв(О2) = 32/4 = 8 г/моль; Мэкв(Н2) =
Вопросы для самоконтроля 1. Какой процесс называют электролизом? 2. Чем отличаются электролиз раствора и расплава электролита? 3. Какова последовательность электродных процессов на катоде электролизера? 4. Какова последовательность электродных процессов на аноде электролизера? 5. Что такое выход по току и от каких факторов он зависит? 6. Какие электроды называют растворимыми и почему? 9.2.4. Домашнее задание № 10 Задание 1. Составьте электродные уравнения процессов, происходящих на инертных электродах, при электролизе водного раствора соли и при заданных условиях (сила тока и время) (см. свой вариант в табл. 27, задание 1). Вычислите массы (и объемы, если вещества газо-
Таблица 27
образные) веществ, выделившихся на катоде и аноде при 95 % выходе по току на катоде и 80 % – на аноде. Задание 2. Составьте электродные уравнения процессов, происходящих на растворимых электродах (см. свой вариант в табл. 27, задание 2). Укажите реакцию среды раствора (рН) до электролиза и изменение рН у анода и катода в процессе электролиза. Лабораторная работа № 11 ЭЛЕКТРОЛИЗ РАСТВОРОВ Цель работы. Изучить сущность процесса электролиза и влияние на процесс состава электролита и материала электродов. Опыт 1. Электролиз раствора натрия сульфата на инертных электродах Выполнение опыта. В электролизную ячейку налейте 0,5М раствора Na2SO4. В катодное пространство введите 3 – 4 капли фенолфталеина, а в анодное – метилоранж. Погрузите в оба колена электролизёра угольные электроды. Электрод, маркированный минусом, погрузите в катодное пространство, а плюсом – в анодное. Включите ток и пропускайте в течение 2–3 минут. Наблюдайте выделение пузырьков газа на электродах и изменение окраски индикаторов. Задание. Сделайте рисунок электролизной ячейки. Напишите уравнения электродных процессов, происходящих при электролизе. В выводе объясните причину изменения окраски индикаторов у катода и анода (свяжите с изменением рН у катода и анода после электролиза). Опыт 2. Электролитическое рафинирование меди Выполнение опыта. В стакан налейте 1М раствор H2SO4 и погрузите медный стержень, содержащий примеси других металлов (состав узнайте у преподавателя). Соедините медный электрод с положительным полюсом внешнего источника тока. В этот же стакан погрузите зачищенный и промытый графитовый стержень и соедините его с отрицательным полюсом источника постоянного тока. Электролиз проводите в течение 10–20 мин. Запишите значения напряжения на электролизере. Задание. Рассчитайте потенциалы возможных равновесных электродных процессов и определите реакции, которые протекали на электродах. Объясните механизм электрохимического рафинирования (очистки) меди и причину расхождения между напряжением электролизера и разностью равновесных потенциалов. По уравнению рассчитайте расход энергии на получение 1 кг рафинированной меди (при выходе по току 100 %) и укажите пути снижения энергии. В выводе укажите сущность электролиза.
где F – постоянная Фарадея, 96500 кулонов/моль = 26,8 А·ч/моль; U – напряжение на электролизере, В; Bj – выход металла по току, %.
9.3. КОРРОЗИЯ МЕТАЛЛОВ И МЕТОДЫ ЗАЩИТЫ Теоретическая часть Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. По механизму протекания различают химическую и электрохимическую коррозию. Химической коррозией называется разрушение металла в результате его окисления в окружающей среде без возникновения электрического тока в системе. В этом случае происходит взаимодействие металла с составными частями среды – газами (газовая коррозия) и неэлектролитами (жидкостная коррозия). Наибольшие материальные потери приносит электрохимическая коррозия. Электрохимической коррозией называют разрушение металла в среде электролита с возникновением внутри системы электрического тока. В этом случае наряду с химическими протекают и электрические процессы (перенос электронов от одного участка к другому). При электрохимической коррозии на поверхности металла появляются анодные и катодные участки, возникает короткозамкнутый гальванический элемент. На анодных участках протекает окисление металла: Ме → Ме n + + n e. На катодных участках – восстановление окислителя. В зависимости от рН среды на катоде могут восстанавливаться ионы водорода или поглощаться кислород: при рН < 7 протекает восстановление ионов водорода: 2Н++2ē→Н2; при рН ≥ 7 протекает восстановление молекул кислорода: О2 +2Н2О + 4ē → ОН–. Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. Коррозия, протекающая с выделением водорода, называется коррозией с водородной деполяризацией. В кислой среде деполяризатором является водород. Коррозия, протекающая с поглощением кислорода, называется коррозией с кислородной деполяризацией. Рассмотрим условия, при которых возможна коррозия с кислородной и водородной деполяризацией. Коррозия как самопроизвольный процесс протекает, если ∆ G < 0. Так как энергия Гиббса непосредственно связана с ЭДС элемента E э = – (∆ G / n F), то возможность протекания коррозии может быть установлена по знаку ЭДС элемента. Если ЭДС элемента имеет положительное значение (Е э > 0), то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя Е э = Е ок – Е восст, то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла: Е ок> Потенциал кислородного электрода при 298 К описывается уравнением:
Потенциал водородного электрода описывается уравнением:
Определить возможность протекания коррозии различных металлов можно по соотношениям: 1) если 2) если 3) если
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.79.136 (0.012 с.) |

 Zn2+ + 2ē ® Zn0
Zn2+ + 2ē ® Zn0




 – электрохимический эквивалент вещества,
– электрохимический эквивалент вещества,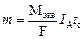 – объединенный закон Фарадея,
– объединенный закон Фарадея, – закон Фарадея для газов,
– закон Фарадея для газов, К(–): восстановление: Na+ + ē ® Na0 *4
К(–): восстановление: Na+ + ē ® Na0 *4

 – ионное уравнение
– ионное уравнение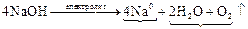 – молекулярное уравнение
– молекулярное уравнение


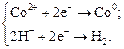
 ,
,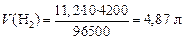 .
. .
. .
. ;
; .
.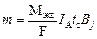 ,
, ,
, .
. ,
, .
. = 1,23 – 0,059рН.
= 1,23 – 0,059рН. = –0,0059 · рН.
= –0,0059 · рН. – коррозия металла невозможна.
– коррозия металла невозможна.


