
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз расплавов и растворов электролитов.Содержание книги
Поиск на нашем сайте
Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через систему, состоящую из двух электродов и расплавов или растворов электролита. То есть окислительно-восстановительные реакции, которые при стандартных условиях самопроизвольно протекать не могут ( Гальваническая ванна – это емкость, заполненная раствором или расплавом электролита. В эту ёмкость помещают электроды, это некоторые твёрдые материалы, которые служат для передачи зарядов частичной для накопления. Электроды соединяются с полюсами источника постоянного тока. Электрод, соединённый с анодом источника тока при электролизе называется катодом [(-)к, (+)а]. На катоде всегда восстановление на аноде окисление. Электроды распределяют на инертные, т. е. которые не участвуют в окислительно-восстановительных реакциях на электроде (угольные электроды, платина, золото, иридий); активные электроны, изготовлены из всех других металлов, чаще всего активными являются аноды. Процесс разрядки ионов водорода и его выделение в пузырьках на электроде проходит в несколько стадий: разрядка ионов, адсорбция атомарного водорода металла, рекомбинация в молекулу, десорбция и зарождение газового пузырька, его развитие и отрыв от поверхности электрода. В результате этих процессов поверхность электрода может быть покрыта слоем адсорбированного водорода, и потенциал электрода изменяется. При большой плотности тока количество выделяющегося водорода может быть настолько большим, что газовая «шуба» вообще изолирует электрод и процесс прекратится. Электролиз расплавов электролитов рассмотрим на примере расплава NiCl2. В расплаве такой соли присутствуют Ni2+ и 2Cl-. Электрод соединенный с анодом источника тока в электролизе служит катодом, катод служит источником электрода, А анод – концептор электрона. Электролиз будит протекать при определенной разности потенциалов, которая называется потенциал разложения (
Практически прилагают разность потенциалов большую, чем Явление поляризации при электролизе. Природа этого явления. Процессы поляризации, определяемые, в общем случае, как разность потенциалов поляризации
На процессы поляризации электродов влияет не только величина тока, но и поверхность электрода, т. е. плотность тока j:
Природа процессов, изменяющих электродные потенциалы различна, и поляризационные процессы можно разделить на несколько типов: 1) Концентрационная поляризация возникает за счёт концентрации ионов в поверхностном слое электрода. 2) Газовая поляризация возникает, главным образом, на катоде гальванического элемента или электролизёра за счёт разрядки ионов водорода. 3) Химическая поляризация изменяет поверхность электрода за счёт реакций со средой или электролита при прохождении электрического тока.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 222; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.255.198 (0.006 с.) |

 ) могут быть осуществлены за счёт электрической энергии при условии пространственного разделения процессов окисления и восстановления. Таким образом химическими источниками тока могут быть реакции для которых
) могут быть осуществлены за счёт электрической энергии при условии пространственного разделения процессов окисления и восстановления. Таким образом химическими источниками тока могут быть реакции для которых 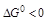 и общий для химического тока и процессов электролиза является пространственное разделение процессов окисления и восстановления. Электролиз производится в специальных устройствах, которые называют электролизёрами (гальванические ванны).
и общий для химического тока и процессов электролиза является пространственное разделение процессов окисления и восстановления. Электролиз производится в специальных устройствах, которые называют электролизёрами (гальванические ванны).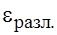 ).
).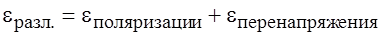
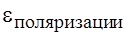 - это минимальная разность потенциалов, которую необходимо приложить, для того чтобы осуществить процесс электролиза данного электролита. Его можно рассчитать, так как при электролизе возникает гальванический элемент. Таким образом, возникает гальванический элемент, который работает против ЭДС источника.
- это минимальная разность потенциалов, которую необходимо приложить, для того чтобы осуществить процесс электролиза данного электролита. Его можно рассчитать, так как при электролизе возникает гальванический элемент. Таким образом, возникает гальванический элемент, который работает против ЭДС источника.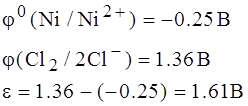
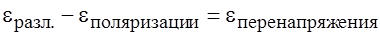
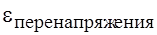 зависит от плотности тока, материала электрода, состояние его поверхности, температуры, конструкции электролизера и электрода.
зависит от плотности тока, материала электрода, состояние его поверхности, температуры, конструкции электролизера и электрода.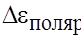 , представляют собой результат изменения электродного потенциала катода и анода под действием проходящего тока:
, представляют собой результат изменения электродного потенциала катода и анода под действием проходящего тока:
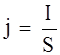 , где S – поверхность электрода (см2, дм2), j – плотность тока (А/см2, А/дм2).
, где S – поверхность электрода (см2, дм2), j – плотность тока (А/см2, А/дм2).


