
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение вещества зависит от природы атомов его образующих.Содержание книги
Поиск на нашем сайте Основные понятия и законы химии. Химия – это наука о веществах и их превращениях. Вещество – каждый отдельный вид материи, обладающий, при данных физических условиях, определенной совокупностью физических свойств. Материя – объективная реальность, данная нам в наших ощущениях. Закон постоянства вещества: каждое вещество имеет постоянный состав независимо от способа получения и местонахождения. Состав вещества – это относительное содержание в нем атомов различного или одного видов. Строение вещества – последовательность расположения в пространстве атомов различного или одного вида. Закон сохранения массы вещества. Закон сохранения массы вещества справедлив только для систем, движущихся со скоростью меньшей скорости света. Масса вещества до реакции равна массе веществ после реакции, потому что количество вещества до реакции равно числу молекул после реакции.
стехиометрические коэффициенты
Учитывая, что в реакции принимают участие атомы, молекулы из одних превращаются в другие, но атомы не превращаются в другие.
Закон эквивалентов.
Вещества взаимодействуют в эквивалентных количествах. Эквивалент вещества – это реальная или условная частица вещества в z раз меньшая, чем соответствующая веществу структурная единица. Эквивалентное количество вещества (
Эквивалентная масса вещества (
Эквивалентные массы и объемы простых и сложных веществ. Для простых веществ:
Масса эквивалента оксида
m – число атомов элемента в оксиде n – валентность элемента Масса эквивалента кислоты
z – число атомов водорода в кислоте Масса эквивалента основания
где z – число гидроксильных групп в основании Масса эквивалента соли
m – число атомов металла в соли n – валентность
Массы реагирующих веществ относятся как молярные массы их эквивалентов. Для газообразных веществ используют понятия эквивалентные объемы – это объем занимаемый 1 моль эквивалента вещества.
Закон Авогадро. Это один из законов естествознания: в равных объёмах любых газов при одинаковых физических условиях содержится одинаковое число частиц (молекул или атомов, если простое вещество, как, например, He, Ar). Этот закон применим также и для ионов и электронов ионизованных газов в том числе, если их концентрация не очень велика и воздействием внешних электрических и магнитных полей можно пренебречь. Позднее (в середине 1850-х годов) Жераром получены следствия из закона Авогадро, на основании которых он предложил метод определения молекулярных масс независимо от химического состава молекул газообразных веществ. Первое следствие: грамм-молекулы любых газов имеют равный объем при одинаковых физических условиях. Молярный объем газа при нормальных условиях (0°С, 760 мм рт. ст.):
Второе следствие: молекулярная масса газообразного вещества равна удвоенной плотности его по водороду (точнее 2,016 плотности). Это следствие из закона Авогадро выводится очень легко. Пусть мы имеем два одинаковых объема разных газов при одинаковых физических условиях. Массы их в данных объемах будут разными:
Строение вещества. Строение атома. Сложность строения атома в конце XIX века стала очевидной в результате множеству научных открытий. Работы Фарадея, показали, что превращение веществ возможны под действием постоянного электрического тока. Откуда следует, что в состав атома входят заряженные частицы, притом, как атом в целом нейтральный. Открытие периодического закона Менделеевым, показало что атомы состоят из единообразных структурных единиц, накопление которых приводит к изменению свойств атомов и эти свойства периодически повторяются, следовательно определяют пространственную организацию структурных единиц атома. Свойство простых веществ (атомов, а также формы и свойства их соединений находятся в периодической зависимости от величины атомных масс. Если увеличится атомная масса, то свойства атома изменятся. Это открытие стимулировало процесс изучения структуры атома. В 1895 году английский ученый Фрупс, изучая электрические разряды в газовых турбинах при пониженном давлении, обнаружил катодные лучи, которые представляют собой поток светящихся заряженных частиц. В 1897 году Томсон определил отношения заряда частиц к их массе и определил, что это величена постоянная для многих зарядов, значит, эти частицы входят в состав всех атомов. Он определил, что это отрицательно заряженные частицы и назвал их электронами.
Мелеккен определил заряд частиц и их массу:
«Атом состоит из положительно заряженной сферы, в которую вкраплены электроны, число электронов определяется положительным зарядом сферы». (Томсон) Одновременно было открыто явление естественной радиоактивности, т. е. самопроизвольный распад атомов тяжелых элементов с превращением их в атомы элементов с меньшей массой и выбросом излучения в виде потоков электронов ( Позднее было показано, что можно вызвать деление ядер любого атома, если оказать на него определенное физическое воздействие (в частности путем бомбардировки атомов ускоренными Резерфорд в1913 году бомбардировал тонкие металлические пластинки ускоренными В 1913 году Мозли измеряя длины волн, излучаемые различными металлами, из которых изготовлен катод рентгеновской трубки, установил функциональную зависимость. После открытия Мозли была изменена форма ПС. Свойства простых веществ, а также форма и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер. Модель атома вещества по Бору. Нильс Бор изучая спектры поглощения и испускания атомов водорода обнаружил, что они имеют линейчатый характер, что атомы излучают энергию дискретно, т.е. определенными порциями, в то время как по Резерфорду электрон двигаясь вокруг ядра должен изменять свою энергию непрерывно и, в конечном счете упасть на ядро, но оказалось, что реальные атомы устойчивы и излучают энергию дискретно, на основании чего не отвергая модели Резерфорда, приписал ей два постулата несвойственных по классическим представлениям свойств. Свою теорию Бор изложил в виде двух постулатов: 1. Электрон, двигаясь вокруг ядра, энергии не излучает. 2. Электрон может вращаться вокруг ядра только по некоторым круговым орбиталям, удовлетворяющим отношению (1). Эти орбитали называются стационарными.
n – число натурального ряда (1;+ Учитывая, что 3. Любое испускание или поглощение энергии атомов происходит при переходе атома из одного стационарного состояния в другое. При переходе атома из стационарного состояния с энергией En в состояние с энергией Em излучается или поглощается квант, частота которого определяется уравнением:
h – постоянная Планка
Модель Бора в противоречие моделей Резерфорда не снимало квантование энергии атомов, физически не объясняла, а искусственно постулировала - стала фундаментальной для квантовой механики. В начале XX века в физике утвердился принцип «корпускулярно-волнового дуализма». Свет распространяется как электромагнитная волна, но линейчатый характер спекторов атома водорода, явление фотоэффекта, свидетельствует, что свет есть поток частиц, такая двойственность природы света позволили Де Бройлю в 1924 году высказать гипотезу, что всякая микрочастица (в том числе электрон) ведут двойственные свойства.
т.е. частица массы m двигаясь со скоростью Квантовые числа. Состояние электрона в квантовой системе определяется четырьмя квантовыми числами: n, l, 1. Главное квантовое число (ввел Бор) Физический смысл: задает размер атомной орбитали и определяет энергетический уровень электрона в атоме. 2. Орбитальное квантовое число, Физический смысл: определяет форму атомной орбитали, энергетический уровень. Атомная орбиталь (АО) – это область околоядерного пространства, для которой вероятность нахождения электрона составляет 95%. Каждый электрон в атоме занимает соответствующую АО, т.е. область определенного размера (n), определенной формы (l) и определенной ориентации в магнитном поле земли. АО могут быть одинакового размера, но разной формы, следовательно, размер задаст энергетический уровень, а форма – энергетический подуровень. Численным значениям орбитального квантового числа в квантовой механике даня соответствующие буквенные значения: Пример: n=2 l = 0 (s-орбиталь) или l = 1(p-орбиталь) l = 2(d-орбиталь) l = 3 (f-орбиталь) 3. Магнитное квантовое число Физический смысл: определяет пространственную ориентацию в магнитном поле. В общем случае число атомных орбиталей определяется суммой значений магнитного квантового числа. 4. Спиновое квантовое число, принимает значение Строение молекул. Химическая связь. При взаимодействии атомов, при определенных условиях между ними может возникнуть химическая связь (х.с.), чем прочнее эта связь, тем больше энергии нужно приложить, чтобы ее разрушить, энергия разрыва связи – энергия связи больше нуля (всегда положительна). При образовании связей, энергии выделяется и образование энергии всегда меньше, чем сумма потенциальной энергии атомов, из которых молекула образована. В современной теории химические связи строятся на основании квантовой механики – метод молекулярных орбиталей (м.м.о.). Метод валентных схем. Основные положения метода валентных схем: · химическая связь образуется двумя электронами с противоположными спинами, причем образующаяся при этом пара принадлежит обоим атомам; · химическая связь есть результат перекрывания атомных орбиталей взаимодействующих атомов; · химическая связь тем прочнее, чем больше область перекрывания атомных орбиталей. Природа и свойства ковалентной связи на примере строения молекул (H2, HCl, H2O). Образование ковалентной неполярной связи. H+H
+ Q Ковалентная связь бывает полярной и неполярной. Ковалентная неполярная связь образуется между двумя одинаковыми атомами ( Сигма связь – это связь, образующаяся при таком перекрывании атомных орбиталей, когда область максимальной орбитальной плоскостью лежит на прямой соединяющей центры атомов.
H2O
Для молекулы воды угол 105,5° вместо 90° между орбиталями атома кислорода получается за счёт взаимного отталкивания атомов водорода, входящих в состав молекулы воды. Свойства ковалентной связи: 1. Всякая ковалентная связь может быть охарактеризована энергией (Q) и длиной связи. 2. Ковалентная связь бывает полярной и неполярной: а) Ковалентная неполярная связь образуется между двумя одинаковыми атомами (
При образовании полярной ковалентной связи общая электронная пара, за счёт которой образована связь, смещена в ту сторону, где большая Электроотрицательность связи. Электроотрицательность – это условие вещества, характеризующее свойство данного атома притягивать к себе общую электронную пару при образовании химической связи. Электроотрицательность атомов в ПСХЭ с возрастом порядкового номера в периоде возрастает, в группе уменьшается (F – самый электроотрицательный атом). В молекулах с полярной ковалентной связью электрические заряды распределены неравномерно и за счет смещения общей электронной пары в сторону электроотрицательности атома на нем появляются избыток отрицательных зарядов, в то время как на другом атоме недостаток. Такие молекулы с неравным распределением зарядов называется диполями. Молекулы с ковалентной полярной связью являются диполями. Такие молекулы надо характеризовать дипольным моментом 3. Ковалентные связи поляризуются. Дипольные моменты поляризованных молекул увеличивается во внешних электрических полях, а также если они попадают в окружение других полярных молекул. Поляризация таких моментов может происходить вплоть до ионизации.
4. Ковалентные связи направлены, т.к. атомные орбитали за счет которых они образуются, определенным образом ориентированы в пространстве. Максимум перекрывания атомных орбиталей обеспечивается при их определенной взаимной ориентации. При этом атомные орбитали, находящиеся в общем владении двух атомов, будут находится под определенным углом друг к другу. Этот угол называется валентным. 5. Ковалентная связь насыщена, каждый из не спаренных электронов атома при ее образовании спаривается, поэтому ковалентная связь может быть кратной. Ионная связь. В случае если ковалентная связь образуется между атомами, Электроотрицательность которых имеет большое различие. Электроотрицательность увеличивается в периодах с ростом заряда ядра и уменьшается в группах. В этом случае атомы ионизируются и удерживаются вместе за счёт электростатического взаимодействия ионов. Ионная связь не насыщена, не направлена, её длина определяется расстоянием между ионами кристаллической решётки. Для соединений ионной связи характерны высокие температуры плавления, кипения, при стандартных условиях эти соединения находятся в кристаллическом виде. Соединения с неполярной ковалентной связью не склонны к межмолекулярным взаимодействиям и в целом к взаимодействиям. Для их активизации необходимо разрушение, путём внешних воздействий. При стандартных условиях находятся в газообразных состояниях. Сходство ковалентной и ионной связи образуется за счет валентных электронов. Основные понятия и законы в термодинамике. Система – произвольно выбранная совокупность тел, находящаяся во взаимодействии. Основное свойство, которой является результат взаимодействия образующих ее частей. Изолированная система – система, не обменивающаяся со средой ни веществом, ни энергией. Закрытая система обменивается со средой энергией, но не обменивается веществом. Если закрытая система получает энергию, она положительна, если отдает – отрицательна. Открытая система обменивается со средой веществом и энергией. Закрытые и изолированные системы создаются человеком с определенными целями. Химические реакции, как правило проводят в закрытых системах. Состояние системы характеризуется параметрами состояния: давления, температуры, объема и компонентный состав, т.е. какие вещества и в каком количестве в системе присутствуют. Внутренняя энергия системы (U) – это общий запас энергии системы, включающий энергию поступательного и вращательного движения молекулы, энергию внутримолекулярных колебаний атома, энергию движения электронов в атоме, внутриядерную энергию, т. е. все виды энергии кроме кинетической энергии движения системы как целого и его потенциальной энергии. Внутренняя энергия является функцией состояния системы, U(P,V,T, Процесс в ходе которого меняется хотя бы один из параметров называется термодинамическим процессом. И в ходе такого процесса изменяться внутренняя энергия системы P2,V1,T1,
Изменение внутренней энергии не зависит от пути перехода системы из первого состояния во второе, а зависит только от начального (U1) и конечного (U2) значения внутренней энергии. Если закрытая система переходит из состояния 1 в состояние 2, она обменивается с внешней средой теплотой и механической энергией, затрачиваемой механической работой. Закон сохранения энергии: теплота, подводимая к системе, затрачивается на изменение внутренней энергии и совершение работы, где работа, действующая против всех сил действующих на систему.
Тепловые эффекты химических реакций. Если в закрытой термодинамической системе протекает химическая реакция Тепловые эффекты реакции при постоянном объеме (Qv) V=V2=const;
Если Если Рекации при V=const могут идти в следующих случаях: 1. в закрытом сосуде (тепловая бомба); 2. между твердыми телами и жидкостями без выделения газа; 3. между газами, если число молекул остается постоянным. Реакции при P=const (тепловой эффект Qp):
Сумма внутренней энергии и произведение объёма на внешнее давление называется энтальпией (
Стандартное состояние. Чтобы сравнивать между собой тепловые эффекты различных реакций необходимо стандартизировать условия, в которых эти реакции протекают (исходные вещества взяты в стехиометрических отношениях). Состояние каждого вещества создается как стандартное состояние. Это физическое состояние, в котором вещество более устойчиво, при P0=101кПа=1атм. и T=298К=25˚С.
Термохимические уравнения – это уравнения химических реакций, в которых рядом с формулой участвующих реакций символом в скобках указывается состояние вещества (твердое – (т), кристаллическое – (к), жидкое – (ж), газообразное – (г), раствор – (р)) и после уравнения через точку с запятой указывается, величена теплового эффекта, при стандартных условиях.
В данной реакции из простых веществ Стандартная терлота образования вещества (
Стандартная теплота образования простых веществ условно принимается равной нулю. Стандартные теплоты образования сложных веществ имеются в справочной таблице.
Термохимические законы и расчёты по ним: 1. Закон Гесса. Тепловой эффект реакции протекающий в несколько стадий равен сумме тепловых эффектов отдельных стадий. Окисление графита.
Следствие из закона Гесса:
То есть тепловой эффект процесса зависит только от вида исходных веществ и продуктов реакций, но не зависит от пути перехода.
Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и исходных веществ. Теплоты образования участников реакции рассчитываются в последующем выражении с учетом коэффициента уравнения реакции. Последнее выражение используется для расчета тепловых эффектов химических реакций, протекающих при стандартных условиях, с использованием справочных данных, по стандартным теплотам образования участников реакций. 2. Закон Лавуазье-Лапласа. Теплота образования вещества численно равна теплоте разложения вещества с противоположным знаком.
Направленность химических реакций. aA+bB=cC+dD Всякая химическая реакция обратима, т.е. может протекать как в прямом, так и в обратном направлении. Поэтому в реакционной смеси всегда присутствуют как исходные вещества, так и продукты реакции. Но отношение будет зависеть от условий, в которых находятся реагирующие вещества. Все реакции обратимы, но в определенных условиях они могут протекать в определенном направлении. Термодинамика позволяет определить направление протекания данной реакции при данных условиях (при t=const и P=const). Самопроизвольно протекают процессы связанные с уменьшением свободной энергии системы. Исходя из этого, самопроизвольно могут протекать реакции в ходе, которых уменьшается свободная энергия системы. При экзотермической реакции теплосодержание уменьшается такие реакции должны идти самопроизвольно (
Следовательно, принцип Бертло-Томсона не распространяется на все реакции. Это объясняется тем, что изменение свободной системы связано не только с изменением ее теплосодержанием, но и с изменением энтропии. Процессы могут протекать и без изменения внутренней энергии Энтропия (S, Дж/К) – это термохимическая функция, мера беспорядка системы, функция вероятности состояния системы. Таким образом, самопроизвольно идут процессы, в ходе которых энтропия увеличивается, то есть растет хаотизация. Обратный процесс требует затраты энергии.
Самопроизвольно может протекать расширение газа в пустоту или в вакуум и процессы смешения.
протекания процесса.
Изменение энтропии не зависит от способа перехода системы из начального состояния в конечное состояние, а определяется лишь исходным и конечным состоянием реагирующих веществ. И если Энтропия вещества зависит от его физического состояния и при переходе из кристаллического в жидкое и газообразное энтропия будет увеличиваться. Энтропия пропорциональна температуре. Изобарно-изотермический потенциал системы – это величина свободной энергии системы при постоянном давлении и температуре, при стандартных условиях, она обозначается G0. В ходе химической реакции имеет место изменение изобарно-термического потенциала.
Основные понятия химической кинетики. Термодинамический расчет позволяет сделать вывод о возможности той или мной реакции и не дает информации о скорости ее протекания. Химическая кинетика изучает, закономерности протекания химических реакций во времени, ее задачей является: - определение скоростей химических реакций; - определение пределов их протекания. То есть такое соотношение исходных веществ и продуктов реакции может быть достигнуто при данных условиях ее проведения. Следовательно, при желании получить продукты реакции с высоким выходом, нужно определить условия реакции, при которых это возможно. Гомогенные и гетерогенные реакции.. Гомогенные реакции – это реакции, протекающие в одной фазе. Гетерогенные реакции – это реакции, протекающие на границе раздела фаз. Фаза – часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачкообразно. Пример: закрытый стакан с водой двухфазная система. Фаза – это гомогенная часть гетерогенной системы. Реагирующие системы характеризуются также по числу компонентов. Компонент системы – это каждое индивидуальное вещество системы, находящееся в определенном физическом состоянии. Примером гомогенных систем служат любые реакции, проходящие в газообразном состоянии, то есть в газовой среде. Гетерогенные реакции распространены в природе и технике и к ним относятся процессы сжигания твердого и жидкого топлива и процессы коррозии металла. Эти реакции протекают на границе раздела фаз. Скорость реакции. В ходе реакции постоянно изменяется количество реагирующих веществ в соответствии с их стехиометрическими отношениями, поэтому для контроля скорости достаточно определять количество хотя бы одного из реагирующих веществ, концентрацию всех других можно рассчитать из уравнения реакции, то все остальные будут изменяться в соответствии с уравнением:
Влияние температуры на скорость реакции грубо определяется правилом Вант Гоффа. При повышении температуры на каждые 10˚С скорость реакции в среднем увеличится в 2-4 раза.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 395; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.016 с.) |





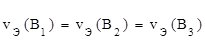
 , моль) – это такое количество вещества, которое в химических реакциях взаимодействует с 1 моль атомов, ионов или электронов водорода.
, моль) – это такое количество вещества, которое в химических реакциях взаимодействует с 1 моль атомов, ионов или электронов водорода.
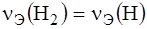
 ) – это масса 1 моль эквивалента вещества.
) – это масса 1 моль эквивалента вещества.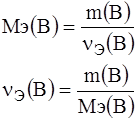
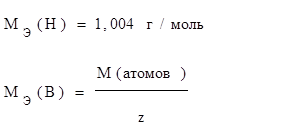 , где z=n – валентность элемента
, где z=n – валентность элемента
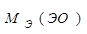


 ,
,

 - это объём 1 моль эквивалента вещества
- это объём 1 моль эквивалента вещества





 ) и потоков
) и потоков  (
( ).
). - частицами).
- частицами).
 ) главное квантовое число, его значение задаёт радиус стационарной орбиты и определяет энергетическое состояние в атоме.
) главное квантовое число, его значение задаёт радиус стационарной орбиты и определяет энергетическое состояние в атоме. для электрона в атоме возможен набор энергетических состояний. Причём только одно состояние будет стационарным, а другие возбуждёнными состояниями.
для электрона в атоме возможен набор энергетических состояний. Причём только одно состояние будет стационарным, а другие возбуждёнными состояниями.
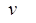 – частота электромагнитного излучения поглощённого или излучённого атомом.
– частота электромагнитного излучения поглощённого или излучённого атомом. ,
, , может стать источником электромагнитного излучения с длиной волны
, может стать источником электромагнитного излучения с длиной волны 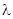 . Волновые свойства электронов были подтверждены в 1925 году Дейнисом и Джерлином, они наблюдали прохождение катодных лучей через кристаллы никеля, таким образом гипотеза Де Бройля нашла свое практическое подтверждение и стала основой для развития нового раздела физико- квантовой механики - изучение движения частиц.
. Волновые свойства электронов были подтверждены в 1925 году Дейнисом и Джерлином, они наблюдали прохождение катодных лучей через кристаллы никеля, таким образом гипотеза Де Бройля нашла свое практическое подтверждение и стала основой для развития нового раздела физико- квантовой механики - изучение движения частиц.
 . Следовательно, в квантовой системе не могут существовать электроны, у которых были бы одинаковыми все четыре квантовых числа.
. Следовательно, в квантовой системе не могут существовать электроны, у которых были бы одинаковыми все четыре квантовых числа. .
. .
. Общее число значений магнитного квантового числа равно:
Общее число значений магнитного квантового числа равно: 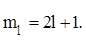
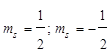 . Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению
. Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению  такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле:
такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле: 
 H2
H2



 ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи  и ковалентные связи
и ковалентные связи  .
.

 + Q
+ Q

 ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.
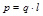 , q – заряд, l – расстояние между атомами. Дипольный момент измеряется в Дебаях (D), 1D = 0,33·10-29Кл·м.
, q – заряд, l – расстояние между атомами. Дипольный момент измеряется в Дебаях (D), 1D = 0,33·10-29Кл·м.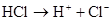
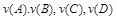 ). Можно охарактеризовать состояние системы параметрами (P1,V1,T1,
). Можно охарактеризовать состояние системы параметрами (P1,V1,T1,  ).
). .
.

 , то в начальном состоянии у нас имеется а моль и b моль вещества A, B, что соответствует закону внутренней энергии U
, то в начальном состоянии у нас имеется а моль и b моль вещества A, B, что соответствует закону внутренней энергии U  , при P, T=const; в конечном состоянии в системе при данных T и P присутствует c, d моль веществ C и D – это соответствует запасу внутренней энергии U
, при P, T=const; в конечном состоянии в системе при данных T и P присутствует c, d моль веществ C и D – это соответствует запасу внутренней энергии U  , при P, T=const. Тепловой эффект реакции при температуре Т – это тепловая энергия Q, которая выделяется или поглощается при взаимной исходности веществ, причем реагенты и продукты реакций находятся при одной и той же температуре.
, при P, T=const. Тепловой эффект реакции при температуре Т – это тепловая энергия Q, которая выделяется или поглощается при взаимной исходности веществ, причем реагенты и продукты реакций находятся при одной и той же температуре. V=0, то Qv=
V=0, то Qv= 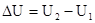 ;
;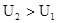 , то Qv>0
, то Qv>0  тепло поглощается (эндотермическая реакция).
тепло поглощается (эндотермическая реакция).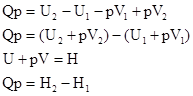
 - энтальпия теплосодержания системы – это сумма внутренней энергии и произведения объема системы на внешнее давление.
- энтальпия теплосодержания системы – это сумма внутренней энергии и произведения объема системы на внешнее давление. - изменение энтальпии (изменение внутреннего содержания системы).
- изменение энтальпии (изменение внутреннего содержания системы).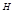 ), имеет размерность энергии и обозначается теплосодержанием системы. Энтальпия, как и внутренняя энергия, является функцией состояния. Её внутреннее значение
), имеет размерность энергии и обозначается теплосодержанием системы. Энтальпия, как и внутренняя энергия, является функцией состояния. Её внутреннее значение 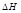 (изменение энтальпии) в ходе термодинамического процесса или входе химической реакции.
(изменение энтальпии) в ходе термодинамического процесса или входе химической реакции.
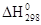 - тепловой эффект реакции протекающий при стандартных условиях.
- тепловой эффект реакции протекающий при стандартных условиях.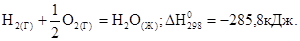
 и
и 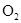 образуется сложное вещество
образуется сложное вещество  тепловой эффект таких реакций называется теплотой образования вещества.
тепловой эффект таких реакций называется теплотой образования вещества.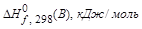 ) – это тепловой эффект образования 1 моль вещества из простых веществ, находящихся в стандартном состоянии.
) – это тепловой эффект образования 1 моль вещества из простых веществ, находящихся в стандартном состоянии. .
.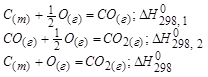

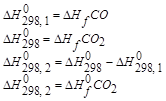



 ), однако данный критерий не является единственным. Изменение свободной энергии определяется также величиной ещё одной термодинамической функции – энтропией. Можно привести пример реакций, которые являются экзотермическими, но самопроизвольно не протекают.
), однако данный критерий не является единственным. Изменение свободной энергии определяется также величиной ещё одной термодинамической функции – энтропией. Можно привести пример реакций, которые являются экзотермическими, но самопроизвольно не протекают.
 и без изменения теплосодержания
и без изменения теплосодержания 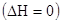 .
.
 Критерии самопроизвольного
Критерии самопроизвольного (В), Дж/моль*К) предназначена для сопоставления и определения энтропии в химической реакции. Можно оценить энтропию для 1 моль любого вещества для стандартных условий. Для энтропии соблюдаются следствия из закона Гесса.
(В), Дж/моль*К) предназначена для сопоставления и определения энтропии в химической реакции. Можно оценить энтропию для 1 моль любого вещества для стандартных условий. Для энтропии соблюдаются следствия из закона Гесса. - изменение энтропии при стандартных условиях в ходе химической реакции.
- изменение энтропии при стандартных условиях в ходе химической реакции.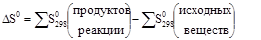
 , то реакции идут самопроизвольно при условии, что
, то реакции идут самопроизвольно при условии, что  .
.
 - состояние равновесия, т. е. прямой и обратный процесс протекает с одинаковыми скоростями и оба направления равновероятны. При
- состояние равновесия, т. е. прямой и обратный процесс протекает с одинаковыми скоростями и оба направления равновероятны. При 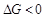 она может при данных температуре и давления протекать самопроизвольно, обратная реакция не возможна.
она может при данных температуре и давления протекать самопроизвольно, обратная реакция не возможна.
 , где
, где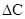 - изменение концентрации одного из участников концентрации;
- изменение концентрации одного из участников концентрации;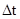 - промежуток времени, за который это изменение произошло;
- промежуток времени, за который это изменение произошло; - мгновенная скорость реакции.
- мгновенная скорость реакции.
 -кинетическое уравнение реакции, где
-кинетическое уравнение реакции, где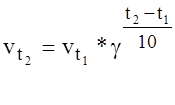
 скорость реакции при температуре
скорость реакции при температуре  ;
; - скорость реакции при температуре
- скорость реакции при температуре  ;
; - температурный коэффициент реакции, который
- температурный коэффициент реакции, который 


