
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон сохранения массы вещества.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Закон сохранения массы вещества справедлив только для систем, движущихся со скоростью меньшей скорости света. Масса вещества до реакции равна массе веществ после реакции, потому что количество вещества до реакции равно числу молекул после реакции.
стехиометрические коэффициенты
Учитывая, что в реакции принимают участие атомы, молекулы из одних превращаются в другие, но атомы не превращаются в другие.
Закон эквивалентов.
Вещества взаимодействуют в эквивалентных количествах. Эквивалент вещества – это реальная или условная частица вещества в z раз меньшая, чем соответствующая веществу структурная единица. Эквивалентное количество вещества (
Эквивалентная масса вещества (
Эквивалентные массы и объемы простых и сложных веществ. Для простых веществ:
Масса эквивалента оксида
m – число атомов элемента в оксиде n – валентность элемента Масса эквивалента кислоты
z – число атомов водорода в кислоте Масса эквивалента основания
где z – число гидроксильных групп в основании Масса эквивалента соли
m – число атомов металла в соли n – валентность
Массы реагирующих веществ относятся как молярные массы их эквивалентов. Для газообразных веществ используют понятия эквивалентные объемы – это объем занимаемый 1 моль эквивалента вещества.
Закон Авогадро. Это один из законов естествознания: в равных объёмах любых газов при одинаковых физических условиях содержится одинаковое число частиц (молекул или атомов, если простое вещество, как, например, He, Ar). Этот закон применим также и для ионов и электронов ионизованных газов в том числе, если их концентрация не очень велика и воздействием внешних электрических и магнитных полей можно пренебречь. Позднее (в середине 1850-х годов) Жераром получены следствия из закона Авогадро, на основании которых он предложил метод определения молекулярных масс независимо от химического состава молекул газообразных веществ. Первое следствие: грамм-молекулы любых газов имеют равный объем при одинаковых физических условиях. Молярный объем газа при нормальных условиях (0°С, 760 мм рт. ст.):
Второе следствие: молекулярная масса газообразного вещества равна удвоенной плотности его по водороду (точнее 2,016 плотности). Это следствие из закона Авогадро выводится очень легко. Пусть мы имеем два одинаковых объема разных газов при одинаковых физических условиях. Массы их в данных объемах будут разными:
Строение вещества. Строение атома. Сложность строения атома в конце XIX века стала очевидной в результате множеству научных открытий. Работы Фарадея, показали, что превращение веществ возможны под действием постоянного электрического тока. Откуда следует, что в состав атома входят заряженные частицы, притом, как атом в целом нейтральный. Открытие периодического закона Менделеевым, показало что атомы состоят из единообразных структурных единиц, накопление которых приводит к изменению свойств атомов и эти свойства периодически повторяются, следовательно определяют пространственную организацию структурных единиц атома. Свойство простых веществ (атомов, а также формы и свойства их соединений находятся в периодической зависимости от величины атомных масс. Если увеличится атомная масса, то свойства атома изменятся. Это открытие стимулировало процесс изучения структуры атома. В 1895 году английский ученый Фрупс, изучая электрические разряды в газовых турбинах при пониженном давлении, обнаружил катодные лучи, которые представляют собой поток светящихся заряженных частиц. В 1897 году Томсон определил отношения заряда частиц к их массе и определил, что это величена постоянная для многих зарядов, значит, эти частицы входят в состав всех атомов. Он определил, что это отрицательно заряженные частицы и назвал их электронами.
Мелеккен определил заряд частиц и их массу:
«Атом состоит из положительно заряженной сферы, в которую вкраплены электроны, число электронов определяется положительным зарядом сферы». (Томсон) Одновременно было открыто явление естественной радиоактивности, т. е. самопроизвольный распад атомов тяжелых элементов с превращением их в атомы элементов с меньшей массой и выбросом излучения в виде потоков электронов ( Позднее было показано, что можно вызвать деление ядер любого атома, если оказать на него определенное физическое воздействие (в частности путем бомбардировки атомов ускоренными Резерфорд в1913 году бомбардировал тонкие металлические пластинки ускоренными В 1913 году Мозли измеряя длины волн, излучаемые различными металлами, из которых изготовлен катод рентгеновской трубки, установил функциональную зависимость. После открытия Мозли была изменена форма ПС. Свойства простых веществ, а также форма и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер. Модель атома вещества по Бору. Нильс Бор изучая спектры поглощения и испускания атомов водорода обнаружил, что они имеют линейчатый характер, что атомы излучают энергию дискретно, т.е. определенными порциями, в то время как по Резерфорду электрон двигаясь вокруг ядра должен изменять свою энергию непрерывно и, в конечном счете упасть на ядро, но оказалось, что реальные атомы устойчивы и излучают энергию дискретно, на основании чего не отвергая модели Резерфорда, приписал ей два постулата несвойственных по классическим представлениям свойств. Свою теорию Бор изложил в виде двух постулатов: 1. Электрон, двигаясь вокруг ядра, энергии не излучает. 2. Электрон может вращаться вокруг ядра только по некоторым круговым орбиталям, удовлетворяющим отношению (1). Эти орбитали называются стационарными.
n – число натурального ряда (1;+ Учитывая, что 3. Любое испускание или поглощение энергии атомов происходит при переходе атома из одного стационарного состояния в другое. При переходе атома из стационарного состояния с энергией En в состояние с энергией Em излучается или поглощается квант, частота которого определяется уравнением:
h – постоянная Планка
Модель Бора в противоречие моделей Резерфорда не снимало квантование энергии атомов, физически не объясняла, а искусственно постулировала - стала фундаментальной для квантовой механики.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 425; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.143.25 (0.009 с.) |





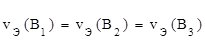
 , моль) – это такое количество вещества, которое в химических реакциях взаимодействует с 1 моль атомов, ионов или электронов водорода.
, моль) – это такое количество вещества, которое в химических реакциях взаимодействует с 1 моль атомов, ионов или электронов водорода.
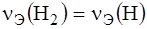
 ) – это масса 1 моль эквивалента вещества.
) – это масса 1 моль эквивалента вещества.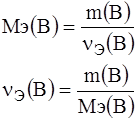
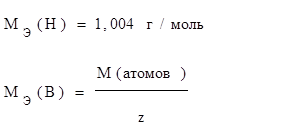 , где z=n – валентность элемента
, где z=n – валентность элемента
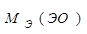


 ,
,

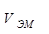 - это объём 1 моль эквивалента вещества
- это объём 1 моль эквивалента вещества





 ) и потоков
) и потоков  (
( ).
). - частицами).
- частицами).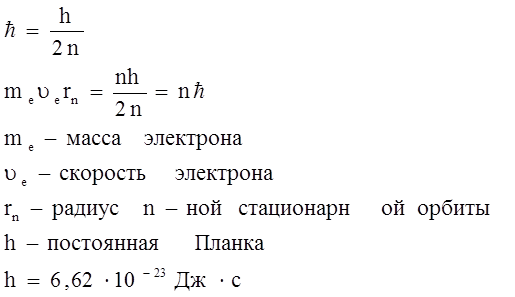
 ) главное квантовое число, его значение задаёт радиус стационарной орбиты и определяет энергетическое состояние в атоме.
) главное квантовое число, его значение задаёт радиус стационарной орбиты и определяет энергетическое состояние в атоме. для электрона в атоме возможен набор энергетических состояний. Причём только одно состояние будет стационарным, а другие возбуждёнными состояниями.
для электрона в атоме возможен набор энергетических состояний. Причём только одно состояние будет стационарным, а другие возбуждёнными состояниями.
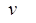 – частота электромагнитного излучения поглощённого или излучённого атомом.
– частота электромагнитного излучения поглощённого или излучённого атомом.


