
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Квантово механическая модель атома.Содержание книги
Поиск на нашем сайте
(В результате развития учения строения атома с одной стороны и природы света с другой.) В начале XX века в физике утвердился принцип «корпускулярно-волнового дуализма». Свет распространяется как электромагнитная волна, но линейчатый характер спекторов атома водорода, явление фотоэффекта, свидетельствует, что свет есть поток частиц, такая двойственность природы света позволили Де Бройлю в 1924 году высказать гипотезу, что всякая микрочастица (в том числе электрон) ведут двойственные свойства.
т.е. частица массы m двигаясь со скоростью Основной принцип квантовой механики. Уравнение Шредингера (волновое уравнение): Решить уравнение Шредингера – это определить значение волновых функций, для которых могут быть по уравнению рассчитаны энергии взаимодействия электронов с атомами. Функции Квантовые числа. Состояние электрона в квантовой системе определяется четырьмя квантовыми числами: n, l, 1. Главное квантовое число (ввел Бор) Физический смысл: задает размер атомной орбитали и определяет энергетический уровень электрона в атоме. 2. Орбитальное квантовое число, Физический смысл: определяет форму атомной орбитали, энергетический уровень. Атомная орбиталь (АО) – это область околоядерного пространства, для которой вероятность нахождения электрона составляет 95%. Каждый электрон в атоме занимает соответствующую АО, т.е. область определенного размера (n), определенной формы (l) и определенной ориентации в магнитном поле земли. АО могут быть одинакового размера, но разной формы, следовательно, размер задаст энергетический уровень, а форма – энергетический подуровень. Численным значениям орбитального квантового числа в квантовой механике даня соответствующие буквенные значения: Пример: n=2 l = 0 (s-орбиталь) или l = 1(p-орбиталь) l = 2(d-орбиталь) l = 3 (f-орбиталь) 3. Магнитное квантовое число Физический смысл: определяет пространственную ориентацию в магнитном поле. В общем случае число атомных орбиталей определяется суммой значений магнитного квантового числа. 4. Спиновое квантовое число, принимает значение
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 219; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.72.254 (0.01 с.) |

 ,
, , может стать источником электромагнитного излучения с длиной волны
, может стать источником электромагнитного излучения с длиной волны 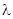 . Волновые свойства электронов были подтверждены в 1925 году Дейнисом и Джерлином, они наблюдали прохождение катодных лучей через кристаллы никеля, таким образом гипотеза Де Бройля нашла свое практическое подтверждение и стала основой для развития нового раздела физико- квантовой механики - изучение движения частиц.
. Волновые свойства электронов были подтверждены в 1925 году Дейнисом и Джерлином, они наблюдали прохождение катодных лучей через кристаллы никеля, таким образом гипотеза Де Бройля нашла свое практическое подтверждение и стала основой для развития нового раздела физико- квантовой механики - изучение движения частиц. должны удовлетворять условиям конечности, однозначности и непрерывности. Эти условия наблюдаются, если
должны удовлетворять условиям конечности, однозначности и непрерывности. Эти условия наблюдаются, если 
 . Следовательно, в квантовой системе не могут существовать электроны, у которых были бы одинаковыми все четыре квантовых числа.
. Следовательно, в квантовой системе не могут существовать электроны, у которых были бы одинаковыми все четыре квантовых числа. .
. .
. Общее число значений магнитного квантового числа равно:
Общее число значений магнитного квантового числа равно: 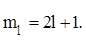
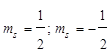 . Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению
. Определяет собственный магнитный момент электрона, т. е. направление вращения атомной орбитали вокруг собственной оси. На одной атомной орбитали, может находиться 2 электрона различных по значению  такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле:
такие электроны называются спаренными. Таким образом, энергия состояния электрона в атоме определяется размером, формой и направлением вращения АО Число электронов, которое может находиться на данном энергетическом уровне, определяется по формуле: 



