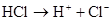Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Распределение электронов в атоме по энергетическим состояниям.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Осуществляется с соблюдения ряда принципов и правил: 1. Учитывая, что атом устойчивая система соблюдения принципа минимума свободной энергии, а, следовательно, заполнение АО в атоме начинается с первого энергетического уровня. Это состояние, соответствует минимуму свободной энергии и, будет называться стационарным. Все другие состояния будут возбужденными. 2. Принцип Паули. Принцип Паули говорит, что в атоме не может быть двух электронов, имеющих одинаковый набор 4-х квантовых чисел.
Значит, на одной АО могут находиться два электрона различных по значению спинового квантового числа.
Периодические изменения свойств элементов в связи с электронной структурой их атомов. Периодическая система элементов Д. И. Менделеева как естественная классификация элементов по электронной структуре их атомов. Периодические изменения свойств химических элементов обнаруженные Д. И. Менделеевым можно объяснить, рассматривая электронную структуру атомов. Положение химического элемента в периодической системе соответствует электронному строению его атома, при этом в одной группе оказываются элементы, имеющие одинаковое число электронов на внешнем энергетическом уровне. Всякие элементы в периодической системе находятся на пересечении горизонтального и вертикального ряда. Номер группы соответствует числу электронов на внешнем энергетическом уровне атома, а номер периода совпадает с числом энергетических уровней в атоме и указывает номер внешнего энергетического уровня. Период – это горизонтальный ряд электронов, расположенных по возрастанию атомной массы, заряда ядра, числа электронов в атоме, начинающийся с типичного металла и заканчивающийся инертным газом
Потенциал ионизации – это энергия, которую необходимо сообщить атому, чтобы превратить его в положительно заряженный ион. В периоде с ростом порядкового номера потенциал ионизации атомов в периоде увеличивается, в группе – уменьшается. Атомы с выраженной способностью отдавать электроны обладают металлическими свойствами, т. е. для них характерен металлический блеск, высокая электропроводность, пластичность, и, вступая во взаимодействие с другими химическими элементами, они отдают электроны, превращаясь в катионы. Металлические свойства в периоде ослабевают, а в группе увеличиваются. Атомные радиусы химических элементов в периоде уменьшаются, т. к. увеличивается число электронов на внешнем электронном уровне и растет энергия взаимодействие с ядром. Элементы внешние энергетические уровни, которых содержат только S-электроны, называются S-элементами. Они находятся в 1 и 2 группе главной подгруппы, это типичные металлы и их валентность, т. е. способность взаимодействовать с определённым числом атомов водорода равна номеру группы. Элементы, у которых при переходе от предыдущего к последующему формируется, P-подуровни называются P-элементами. P-элементы, 3-группы являются амфотерными, т. е. обладают свойствами металлов и неметаллов. Элементы 5,6,7 групп – это типичные неметаллы, т. е. вступая в соединение, принимают электроны, превращаясь в анионы, для них характерна отрицательная степень окисления (для металлов положительная). Их высшая положительная степень окисления равна номеру группы в которой они находятся, максимальная отрицательная степень окисления равна 8. Все элементы кроме O2 могут, как отдавать, так и принимать электроны, в зависимости от того с каким элементом они взаимодействуют. В периодической системе имеется 3 малых и 4 больших периода (большие периоды состоят из двух рядов). Большинство элементов в ПСХЭ металлы, в то же время металлы, могут применять свойства в широком диапазоне, т.к. это элементы, имеющие различное строение предвнешних энергетических уровней, т.е. металлы s, d – семейства, позволяющие иметь большое многообразие веществ и материи на их основе, обладающих различными свойствами в зависимости от условий, в которых они находятся. В целом любой элемент ПСХЭ уникален, т.к. имеет свою собственную электронную конфигурацию. Свои собственные возможности стабилизации энергетических состояний или за счет перехода электронов на вакантные атомные орбитали (d и f – элементы), или за счет взаимодействия с другими атомами с отдачей электронов или их принятием. Периодическое изменение свойств химических элементов объясняется периодическим повторением электронной конфигурации внешних энергетических уровней.
Энергия ионизации, сродство к электрону и Электроотрицательность. Потенциал ионизации – это энергия, которую необходимо сообщить атому, чтобы превратить его в положительно заряженный ион. В периоде с увеличением порядкового номера потенциалы ионизации атомов возрастают, т. е. способность атомов отдавать электроны уменьшается. Атомы с выраженной способностью отдавать электроны обладают металлическими свойствами, т. е. для них характерен металлический блеск, высокая электропроводность, пластичность, и, вступая во взаимодействие с другими химическими элементами, они отдают электроны, превращаясь в катионы. Металлические свойства в периоде ослабевают, а в группе увеличиваются. Атомные радиусы химических элементов в периоде уменьшаются, т. к. увеличивается число электронов на внешнем электронном уровне и растет энергия взаимодействие с ядром. Элементы внешние энергетические уровни, которых содержат, только S-электроны называются S-элементами. Они находятся в 1 и 2 группе главной подгруппы, это типичные металлы и их валентность, т. е. способность взаимодействовать с определённым числом атомов водорода равна номеру группы. Элементы, у которых при переходе от предыдущего к последующему формируется, P-подуровни называются P-элементами. P-элементы 3 группы являются амфотерными, т. е. обладают свойствами металлов и неметаллов. Элементы 5,6,7 групп – это типичные неметаллы, т. е. вступая в соединение, принимают электроны, превращаясь в анионы, для них характерна отрицательная степень окисления (для металлов положительная). Их высшая положительная степень окисления равна номеру группы в которой они находятся, максимальная отрицательная степень окисления равна 8. Все элементы кроме O2 могут как отдавать, так и принимать электроны, в зависимости от того с каким элементом они взаимодействуют. В периодической системе имеется 3 малых и 4 больших периода (большие периоды состоят из двух рядов).
1)Могут обладать переменной валентностью; 2)Обладают специфическими физическими свойствами (например, электропроводность) за счёт вакантных d-орбиталей. В 6 периоде от La – Lu и в 7 от Ac – Lr формируются подуровни f:
Один и тот же атом может принимать электроны, проявляя к ним сродство, или отдавать электроны другому атому, у которого сродство к электрону больше. Электроотрицательность позволяет оценить возможность взаимодействия между данными атомами и прогнозировать распределение зарядов электронных облаков в образующемся соединении. Электроотрицательность представляет собой периодическую функцию, величина которой позволяет оценивать поведение атома данного элемента при химических реакциях, а также влияние этого атома на распределение электронной плотности в уже готовых молекулах. Энергия ионизации — энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в основном энергетическом состоянии; обычно выражается в электрон-вольтах. Многоэлектронные атомы имеют несколько значений энергии ионизации: I1, I2..., соответствующих отрыву первого, второго и т. д. электронов, при этом всегда 71</2</3<.... Энергия ионизации периодически изменяется. Для элементов каждого периода она возрастает слева направо с увеличением заряда ядра; в главных подгруппах уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра, а в побочных подгруппах наблюдается более сложная закономерность (сначала уменьшается, а затем растет). Строение молекул. Химическая связь. При взаимодействии атомов, при определенных условиях между ними может возникнуть химическая связь (х.с.), чем прочнее эта связь, тем больше энергии нужно приложить, чтобы ее разрушить, энергия разрыва связи – энергия связи больше нуля (всегда положительна). При образовании связей, энергии выделяется и образование энергии всегда меньше, чем сумма потенциальной энергии атомов, из которых молекула образована. В современной теории химические связи строятся на основании квантовой механики – метод молекулярных орбиталей (м.м.о.). Метод валентных схем. Основные положения метода валентных схем: · химическая связь образуется двумя электронами с противоположными спинами, причем образующаяся при этом пара принадлежит обоим атомам; · химическая связь есть результат перекрывания атомных орбиталей взаимодействующих атомов; · химическая связь тем прочнее, чем больше область перекрывания атомных орбиталей. Природа и свойства ковалентной связи на примере строения молекул (H2, HCl, H2O). Образование ковалентной неполярной связи. H+H
+ Q Ковалентная связь бывает полярной и неполярной. Ковалентная неполярная связь образуется между двумя одинаковыми атомами ( Сигма связь – это связь, образующаяся при таком перекрывании атомных орбиталей, когда область максимальной орбитальной плоскостью лежит на прямой соединяющей центры атомов.
H2O
Для молекулы воды угол 105,5° вместо 90° между орбиталями атома кислорода получается за счёт взаимного отталкивания атомов водорода, входящих в состав молекулы воды. Свойства ковалентной связи: 1. Всякая ковалентная связь может быть охарактеризована энергией (Q) и длиной связи. 2. Ковалентная связь бывает полярной и неполярной: а) Ковалентная неполярная связь образуется между двумя одинаковыми атомами (
При образовании полярной ковалентной связи общая электронная пара, за счёт которой образована связь, смещена в ту сторону, где большая Электроотрицательность связи. Электроотрицательность – это условие вещества, характеризующее свойство данного атома притягивать к себе общую электронную пару при образовании химической связи. Электроотрицательность атомов в ПСХЭ с возрастом порядкового номера в периоде возрастает, в группе уменьшается (F – самый электроотрицательный атом). В молекулах с полярной ковалентной связью электрические заряды распределены неравномерно и за счет смещения общей электронной пары в сторону электроотрицательности атома на нем появляются избыток отрицательных зарядов, в то время как на другом атоме недостаток. Такие молекулы с неравным распределением зарядов называется диполями. Молекулы с ковалентной полярной связью являются диполями. Такие молекулы надо характеризовать дипольным моментом 3. Ковалентные связи поляризуются. Дипольные моменты поляризованных молекул увеличивается во внешних электрических полях, а также если они попадают в окружение других полярных молекул. Поляризация таких моментов может происходить вплоть до ионизации.
4. Ковалентные связи направлены, т.к. атомные орбитали за счет которых они образуются, определенным образом ориентированы в пространстве. Максимум перекрывания атомных орбиталей обеспечивается при их определенной взаимной ориентации. При этом атомные орбитали, находящиеся в общем владении двух атомов, будут находится под определенным углом друг к другу. Этот угол называется валентным. 5. Ковалентная связь насыщена, каждый из не спаренных электронов атома при ее образовании спаривается, поэтому ковалентная связь может быть кратной. Ионная связь. В случае если ковалентная связь образуется между атомами, Электроотрицательность которых имеет большое различие. Электроотрицательность увеличивается в периодах с ростом заряда ядра и уменьшается в группах. В этом случае атомы ионизируются и удерживаются вместе за счёт электростатического взаимодействия ионов. Ионная связь не насыщена, не направлена, её длина определяется расстоянием между ионами кристаллической решётки. Для соединений ионной связи характерны высокие температуры плавления, кипения, при стандартных условиях эти соединения находятся в кристаллическом виде. Соединения с неполярной ковалентной связью не склонны к межмолекулярным взаимодействиям и в целом к взаимодействиям. Для их активизации необходимо разрушение, путём внешних воздействий. При стандартных условиях находятся в газообразных состояниях. Сходство ковалентной и ионной связи образуется за счет валентных электронов.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 846; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.008 с.) |







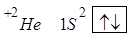



 свойства атомов определяются строением внешнего энергетического уровня, т. е. числом электронов на этом уровне и номером этого уровня. Номер уровня определяет расстояние электрона от ядра. Таким образом, свойства элементов изменяются периодически в связи с тем, что периодически повторяется структура внешнего энергетического уровня атома. В периоде с ростом порядкового номера идет формирование нового энергетического уровня, и при переходе от предыдущего к последующему число электронов возрастает, увеличивается энергия взаимодействия внешнего электрона с ядром атома, а значит, уменьшается способность атомов отдавать электроны, может быть количественно выражено потенциалом ионизации. Такие атомы с одинаковой структурой внешнего энергетического уровня находятся в одной группе и обладают сходными свойствами. Электроны внешних энергетических уровней называются валентными электронами. Именно они определяют способность атомов к взаимодействию с другими атомами. Элементы, находящиеся в 1-3 группе вступая во взаимодействие, отдают электроны и при этом превращаются в положительно заряженные ионы (катионы), приобретая устойчивую восьми электронную оболочку.
свойства атомов определяются строением внешнего энергетического уровня, т. е. числом электронов на этом уровне и номером этого уровня. Номер уровня определяет расстояние электрона от ядра. Таким образом, свойства элементов изменяются периодически в связи с тем, что периодически повторяется структура внешнего энергетического уровня атома. В периоде с ростом порядкового номера идет формирование нового энергетического уровня, и при переходе от предыдущего к последующему число электронов возрастает, увеличивается энергия взаимодействия внешнего электрона с ядром атома, а значит, уменьшается способность атомов отдавать электроны, может быть количественно выражено потенциалом ионизации. Такие атомы с одинаковой структурой внешнего энергетического уровня находятся в одной группе и обладают сходными свойствами. Электроны внешних энергетических уровней называются валентными электронами. Именно они определяют способность атомов к взаимодействию с другими атомами. Элементы, находящиеся в 1-3 группе вступая во взаимодействие, отдают электроны и при этом превращаются в положительно заряженные ионы (катионы), приобретая устойчивую восьми электронную оболочку.
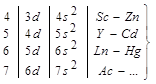 Идёт формирование d-подуровней, формируется от предыдущего к последующему предвнешние энергетические уровни. Имея два или один электрон на внешнем энергетическом уровне, все они являются металлами, их называют d-элементами. У большинства из них d-подуровни являются не завершёнными, поэтому они:
Идёт формирование d-подуровней, формируется от предыдущего к последующему предвнешние энергетические уровни. Имея два или один электрон на внешнем энергетическом уровне, все они являются металлами, их называют d-элементами. У большинства из них d-подуровни являются не завершёнными, поэтому они: La – Lu (4f), Ac – Lr (5f). Их называют f-элементы. Из отдельной клеточки они вынесены в отдельную строку, их называют лантаноиды и актиноиды. Это металлы. Работа отрыва электрона от отрицательно заряженного иона, измеренная спектрально или методом Франка и Герца, характеризует сродство к электрону. Сродство к электрону E и первый потенциал ионизации I1 определяют химическую активность атома – его окислительные или восстановительные свойства.
La – Lu (4f), Ac – Lr (5f). Их называют f-элементы. Из отдельной клеточки они вынесены в отдельную строку, их называют лантаноиды и актиноиды. Это металлы. Работа отрыва электрона от отрицательно заряженного иона, измеренная спектрально или методом Франка и Герца, характеризует сродство к электрону. Сродство к электрону E и первый потенциал ионизации I1 определяют химическую активность атома – его окислительные или восстановительные свойства. H2
H2



 ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами. Различают ковалентные связи  и ковалентные связи
и ковалентные связи  .
.

 + Q
+ Q

 ) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.
) и число таких связей в молекуле будет определяться числом не спаренных электронов во внешнем энергетическом уровне атома. Полярная ковалентная связь образуется между двумя разными атомами.
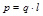 , q – заряд, l – расстояние между атомами. Дипольный момент измеряется в Дебаях (D), 1D = 0,33·10-29Кл·м.
, q – заряд, l – расстояние между атомами. Дипольный момент измеряется в Дебаях (D), 1D = 0,33·10-29Кл·м.