Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Х-ка состояния электрона в атоме с помощью квантовых чисел.Содержание книги
Поиск на нашем сайте
1. Электронное облако – это модель квантовой механики, описывающая движение электрона в атоме. 2. Орбиталь (s, p, d, f) – часть атомного пространства, в котором вероятность нахождения данного электрона наибольшая (~ 90%). 3.Энергетический уровень – это энергетический слой с определённым уровнем энергии находящихся на нём электронов. Число энергетических уровне в атоме химического элемента равно номеру периода, в котором этот элемент расположен. 4. Максимально возможное число электронов на данном энергетическом уровне определяется по формуле: N = 2n2, где n – номер периода. 5. Состояние электрона в атоме описывается 5 квантовыми числами (n, l, ml, ms, s). 6. Движение электрона в атоме описывается 4 квантовыми числами: А) n – главное квантовое число, определяет энергию электрона и размеры электронного облака (n = 1,..7) Б) l - орбитальное квантовое число, определяет форму орбитали (s, p, d, f) и принимает значения l = 0,..n-1. В) ml – магнитное квантовое число, определяет ориентацию орбиталей в пространстве и принимает значения ml = -l…0…+1. Г) ms – спиновое квантовое число, определяет направление вращения электрона вокруг своей оси и принимает только два значения +1/2 или-1/2.
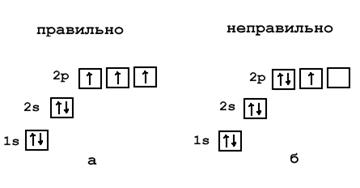
8. При заполнении электронами атомных орбиталей соблюдаются следующие три правила: 1. Принцип устойчивости. Орбитали заполняются начиная с имеющих самую низкую энергию и далее в порядке её повышения. В этом случае энергия атома является минимальной, а устойчивость – максимальной. энергетическая последовательность легко может быть описана при помощи правила суммы двух первых квантовых чисел n+l. Это правило носит название правила Клечковского (1951 г.): При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного квантового числа l, т.е. n+l, имеет меньшее значение. 2. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовые числа были бы одинаковыми. На любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположно направленные спины. Такие электроны называются спаренными. 3. Правило Хунда (1925 г.). Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Заполнение энергетических орбиталей азота: а - правильная схема, б - неправильная схема.
9. Периодичность - это повторяемость свойств химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элементов. Она связана, в первую очередь, с повторяемостью электронного строения атомов по мере увеличения порядкового номера (а, следовательно, заряда ядра и числа электронов в атоме). Химическая периодичность проявляется в аналогии химического поведения, однотипности химических реакций. При этом число валентных электронов, характерные степени окисления, формулы соединений могут быть разными. Периодически повторяются не только сходные черты, но и существенные различия химических свойств элементов по мере роста их порядкового номера. Химические свойства элементов проявляются при взаимодействии их атомов. Периодическая система элементов отражает закономерное изменение этих свойств. Типы конфигураций внешних энергетических уровней атомов определяют основные особенности химического поведения элементов. Эти особенности являются специфическими для элементов главных подгрупп (s- и p-элементы), побочных подгрупп (-элементы) и -элементов (лантаноиды и актиноиды). Особое место занимают элементы первого периода (Н и Не). Высокая химическая активность атомарного водорода объясняется способностью легко отдавать единственный -элекрон, тогда как электронная конфигурация атома гелия весьма устойчива, что обусловливает его химическую инертность.
10. Современная формулировка периодического закона Д. И. Менделеева такова: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда атомных ядер. При построении периодической системы Менделеев руководствовался принципом расположения элементов по возрастающим атомным массам. Однако, как видно из таблицы, в трех случаях этот принцип оказался нарушенным. Так, аргон (атомная масса 39,948 а. е. м.) стоит до калия (39,098 а. е. м.), кобальт (58,9332 а. е. м.) находится до никеля (58,70 а. е. м.) и теллур (127,60 а. е. м.) до иода (126,9045 а. е. м.). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств.
12. Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору). Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
13. Донорно-акцепторный механизм. Именно с позиций донорно-акцепторного механизма описывается образование локализованных ковалентных связей в молекулах и молекулярных ионах комплексных соединений: связь формируется за счёт неподелённой пары электронов лиганда и свободной орбитали атома-комплексообразователя. Донорно-акцепторный механизм также описывает образование промежуточных продуктов реакции, например, комплексов с переносом заряда. Вид донорно-акцепторного взаимодействия — основной способ образования комплексных соединений. Подобное взаимодействие отвечает за многие кислотно-основные превращения, связанные с переносом иона водорода (акцептора), а также образование супрамолекулярных наноструктур.
|
||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.88.104 (0.01 с.) |