
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение и физический смысл величин относительная молекулярная масса вещества, молярная масса в-ва, химическое количество вещества, молярный объем газов.Содержание книги
Поиск на нашем сайте
Определение и физический смысл величин относительная молекулярная масса вещества, молярная масса в-ва, химическое количество вещества, молярный объем газов. Относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr. Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Относительная молек. масса воды: Как известно, закон Авогадро применим только к газообразным веществам. Но химикам необходимо иметь представление о количестве молекул и в порциях жидких или твердых веществ. Поэтому для сопоставления числа молекул в веществах химиками была введена величина – молярная масса. Молярная масса обозначается М, она численно равна относительной молекулярной массе. Молярная масса измеряется в г/моль. Физический смысл молярной массы в том, что эта масса 1 моль вещества. Количество вещества Отношение массы вещества к его молярной массе называется количеством вещества. Количество вещества обозначается n. Это количественная характеристика порции вещества, наряду с массой и объемом. Измеряется количество вещества в молях. 1 моль вещества содержит
Молярный объем В соответствии с законом Авогдро, 1 моль любого газа будет занимать один и тот же объем. Объем одного моля газа называется молярным объемом и обозначается Vn. При нормальных условиях (а это 0 °С и нормальное давление) молярный объем равен 22,4 л/моль. Тогда количество вещества газа при н.у. можно вычислить как отношение объема газа к молярному объему.
5. Атом - наименьшая частица химического элемента, обладающая всеми его свойствами. Атом состоит из ядра и «облака» электронов вокруг него. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов. Взаимодействуя, атомы могут образовывать молекулы. Атом — предел химического разложения любого вещества. Простое вещество (если оно не является одноатомным, как, например, гелий He) разлагается на атомы одного вида, сложное вещество — на атомы разных видов.
Радиоакти́вный распа́д— спонтанное изменение состава (заряда Z, массового числа A) или внутреннего строения нестабильных атомных ядер путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов. Ядро, испытывающее радиоактивный распад, и ядро, возникающее в результате этого распада, называют соответственно материнским и дочерним ядрами. В геологии методы, основанные на радиоактивном распаде, позволили определить возраст древнейших горных пород.
6. А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам. АТОМНЫЙ НОМЕР - число протонов в ядре атома элемента, равное числу электронов, движущихся вокруг этого ядра. Атомный номер ставят в виде нижнего индекса перед символом элемента; например, атомный номер углерода записывается как 6С. Атомный номер определяет химические свойства элемента и его положение в периодической таблице. У всех изотопов элемента один и тот же атомный номер, но разные атомные массы, поскольку число нейтронов у них различно. Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы, которая также называется дальтоном. Радионукли́ды, радиоакти́вные нукли́ды — нуклиды, ядра которых нестабильны и испытывают радиоактивный распад. Большинство известных нуклидов радиоактивны.
Характ. Ковалентной связи. Важными колличественными х-ми ковалентной связи являются энергия связи, длина и дипольный момент. · Кратность (или порядок) ковалентной связи между двумя атомами — это число электронных пар, непосредственно связывающих эти атомы. Если такая пара одна, то говорят об одинарной связи. Например, атом водорода во всех соединениях связан одинарной связью, поскольку он всегда одновалентен (его валентная оболочка вмещает лишь одну электронную пару). Но бывает, что одни и те же атомы соединены двумя СЭП, и тогда говорят, что связь между этими атомами двойная.
· Энергия ковалентной связи — это минимальная энергия, которую необходимо затратить, чтобы связь полностью разорвать. Энергия связи характеризует её прочность; поскольку разорвать одну связь очень легко, обычно приводят значения энергии в расчёте на один моль (6,02·1023) связей. Для большинства ковалентных связей величина энергии находится в диапазоне от 100 до 1000 кДж/моль: При прочих равных энергия связи растёт с увеличением кратности, но не пропорционально (двойная связь обычно менее чем в два раза прочнее одинарной). Одной из самых прочных является тройная связь C≡O в молекуле угарного газа: её энергия составляет 1077 кДж/моль · Длина ковалентной связи есть расстояние между ядрами связанных атомов; обычно оно находится в пределах от 0,1 до 0,3 нанометров (нм). В первом приближении длина связи равна сумме атомных радиусов, поэтому, например, связь в молекуле водорода H2 рекордно короткая (0,074 нм), а в молекуле астата At2 — очень длинная (0,283 нм). Межъядерное расстояние является компромиссом между сближением атомов связывающими электронными парами и взаимным отталкиванием атомных ядер, поэтому связь становится короче с увеличением кратности. 20. Координационные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.Комплексные соединения, имеющие внешнюю сферу, в водном растворе полностью диссоцируют на комплексный малодиссоцирующий катион или анион. Комплексные соединения без внешней сферы в воде нерастворимы (например, карбонилы металлов). Координационные соединения разнообразны и многочисленны.
21.Теория координационных соединений, предложенная А. Вернером в 1893 году. Основн положения:1. Большинство элементов проявляет два типа валентности – главную и побочную. 2. Атом элемента стремится насытить не только главные, но и побочные валентности. 3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства. Ко́мплексные соединения или координационные соединения — частицы которые образуются в результате присоединения к данному иону, называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Типы комплексных соединений. По заряду комплекса 1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др 3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.[Ni(CO)4] — тетракарбонилникель, [Pt(NH3)2Cl2] — дихлородиамминплатина(II) По числу мест,занимаемых лигандами в координационной сфере.
1) Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н2О, NH3, CO, NO и др.) и заряженными (ионы CN−, F−, Cl−, OH−, SCN−, и др.). 2) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H2N — CH2 — COO−, оксалатный ион −O — CO — CO — O−, карбонат-ион СО32−, сульфат-ион SO42−, тиосульфат-ион S2O32−. 3) Полидентатные лиганды. Например, комплексоны — органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота — ЭДТА). Циклические комплексы, образуемые некоторыми полидентатными лигандами, относят к хелатным (гемоглобин и др.). По природе лиганда 1) Аммиакаты — соединения, в которых лигандами служат молекулы аммиака. 2) Аквакомплексы — в которых лигандом выступает вода. 3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II) 4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки.5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы. Номенклатура. 1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион.2) Название комплексной части начинают с указания состава внутренней сферы. Например: Cl− — хлоро, CN− — циано, SCN− — тиоцианато. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил.3) Число монодентатных лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д.4) Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя.5) После обозначения состава внутренней сферы называют внешнюю сферу.6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается.
22. устойчивость комплексных соединений в растворах. константа нестойкости комплексных ионов. Произведение констант ступенчатого комплексообразования равно полной константе образования комплекса (полной константе устойчивости) β:M+nL=MLn, β = а(MLn)/a(M)a(L)nЕсли коэффициенты активности реагентов равны единице (условие, которое бывает справедливо для сильно разбавленных растворов), то равновесные активности равны равновесным концентрациям. Тогда Константа устойчивости комплекса равна его концентрационной константе устойчивости:β= [MLn]/[M][L]nЧем больше константа устойчивости, тем прочнее комплекс в растворе, тем полнее ионы металла M связываются в комплекс.Реакция диссоциации комплекса в общем виде характеризуется полной истинной термодинамической константой равновесия Кн: Кн= а(M)a(L)n / а(MLn)Константа устойчивости есть величина, обратная константе нестойкости: β= 1/Kн Произведение всех ступенчатых констант нестойкости равно полной константе нестойкости комплекса:Кн,1Кн,2….Кн,n=КнКонстанты устойчивости комплексов часто имеют очень высокие числовые значения, берут десятичный логарифм lgβ.
Константа нестойкости комплексного иона характеризует прочность внутренней сферы комплексного соединения. Константы нестойкости комплексных ионов являются мерой их относительной устойчивости, подобно тому как константы диссоциации слабых электролитов являются мерой их относительной силы. Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. Если константа нестойкости комплексного иона значительно меньше произведения растворимости соответствующего осадка, содержащего комплексообразователь, можно предполагать, что произойдет растворение его. Наоборот, если произведение растворимости осадка, содержащего ион, входящий в состав комплекса, значительно меньше константы нестойкости комплексного иона, последний может быть разрушен, и его комплексообразователь войдет в состав осадка. 23. понятие о скорости гомогенных и гетерогенных химических реакций. Скорость химической реакции измерятся изменением количества вещества одного из реагентов или продуктов реакции в единицу времени в единицу объёма для гомогенных систем или на единицу поверхности для гетерогенных систем. Для гомогенных систем, для которых реакция происходит во всем объёме системы, скорость химической реакции определяется следующим уравнением: -скорость химической реакции – изменение количества вещества V – объём системы – интервал времени, в котором определяют скорость реакцииОтношение ± ∆n / V – это молярная концентрация вещества. И тогда ± ∆с. Для гомогенных систем скорость реакции выражается в Для гетерогенных систем, в которых реакция протекает на границе раздела фаз, уравнение для определения скорости химической реакции будет такое: S – Площадь поверхности раздела фаз, на которой идет химическая реакция. Скорость реакции – величина положительная, поэтому знак ± перед формулой дает возможность выбора. Ставится (+), если скорость реакции определяется по изменению количества продукта реакции. Раздел химии, в котором изучаются скорости химических реакций, называется химической кинетикой.
Органическая химия. Структурная изомерия. Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства
Явление существования изомеров называется изомерией. Изомеры – вещества, имеющие одинаковую молекулярную, но разную структурную формулу. В зависимости от характера отличий в строении изомеров различают структурную и пространственную изомерию.Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением. Структурная изомерия делится на: 1.Изомерию углеродного скелета 2.Изомерию положения (кратной связи, функциональной группы, заместителя) 3.Межклассовую изомерию CH3-CH2-NO2 нитроэтан HOOC-CH2-NH2 аминоуксусная кислота (глицин) Изомерия положения кратной связи СН2=СН-СН=СН2 СН3-СН=С=СН2 функциональной группы СН3-СНОН-СН3 СН2ОН-СН2-СН3 Заместителя СН3-СНCI-СН3 СН2CI-СН2-СН3 Структурная изомерия
Определение и физический смысл величин относительная молекулярная масса вещества, молярная масса в-ва, химическое количество вещества, молярный объем газов. Относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr. Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Относительная молек. масса воды: Как известно, закон Авогадро применим только к газообразным веществам. Но химикам необходимо иметь представление о количестве молекул и в порциях жидких или твердых веществ. Поэтому для сопоставления числа молекул в веществах химиками была введена величина – молярная масса. Молярная масса обозначается М, она численно равна относительной молекулярной массе. Молярная масса измеряется в г/моль. Физический смысл молярной массы в том, что эта масса 1 моль вещества. Количество вещества Отношение массы вещества к его молярной массе называется количеством вещества. Количество вещества обозначается n. Это количественная характеристика порции вещества, наряду с массой и объемом. Измеряется количество вещества в молях. 1 моль вещества содержит
Молярный объем В соответствии с законом Авогдро, 1 моль любого газа будет занимать один и тот же объем. Объем одного моля газа называется молярным объемом и обозначается Vn. При нормальных условиях (а это 0 °С и нормальное давление) молярный объем равен 22,4 л/моль. Тогда количество вещества газа при н.у. можно вычислить как отношение объема газа к молярному объему.
5. Атом - наименьшая частица химического элемента, обладающая всеми его свойствами. Атом состоит из ядра и «облака» электронов вокруг него. Ядро состоит из положительно заряженных протонов и нейтральных нейтронов. Взаимодействуя, атомы могут образовывать молекулы. Атом — предел химического разложения любого вещества. Простое вещество (если оно не является одноатомным, как, например, гелий He) разлагается на атомы одного вида, сложное вещество — на атомы разных видов. Радиоакти́вный распа́д— спонтанное изменение состава (заряда Z, массового числа A) или внутреннего строения нестабильных атомных ядер путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов. Ядро, испытывающее радиоактивный распад, и ядро, возникающее в результате этого распада, называют соответственно материнским и дочерним ядрами. В геологии методы, основанные на радиоактивном распаде, позволили определить возраст древнейших горных пород.
6. А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам. АТОМНЫЙ НОМЕР - число протонов в ядре атома элемента, равное числу электронов, движущихся вокруг этого ядра. Атомный номер ставят в виде нижнего индекса перед символом элемента; например, атомный номер углерода записывается как 6С. Атомный номер определяет химические свойства элемента и его положение в периодической таблице. У всех изотопов элемента один и тот же атомный номер, но разные атомные массы, поскольку число нейтронов у них различно. Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы, которая также называется дальтоном. Радионукли́ды, радиоакти́вные нукли́ды — нуклиды, ядра которых нестабильны и испытывают радиоактивный распад. Большинство известных нуклидов радиоактивны.
|
|||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 253; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.45.122 (0.013 с.) |

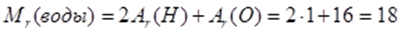
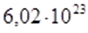 частиц. Это число называется числом Авогадро. Если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.
частиц. Это число называется числом Авогадро. Если к нему добавить единицу измерения – 1/моль, то это будет физическая величина – постоянная Авогадро, которая обозначается NА.



