
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные закономерности протекания химических реакций.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества. Химическая реакция – это процесс в ходе, которого из одних веществ образуются другие.
В ходе химических реакций происходит разрушение одних химических связей и образование других. На разрыв связи расходуется энергия, а при образовании – выделяется. В связи с этим любая химическая реакция сопровождается энергетическим эффектом. Т.е. выделением или поглощением энергии. Эта энергия может быть затрачена или получена в различных видах: 1. тепловой; 2. электрический; 3. световой (электромагнитное излучение). Задачами термохимической динамики являются: 1. определение физических эффектов химических реакций, в частности тепловых; 2. изменение свободной энергии системы с целью оценки возможности протекания данной реакции при данных условиях. Основные понятия и законы в термодинамике. Система – произвольно выбранная совокупность тел, находящаяся во взаимодействии. Основное свойство, которой является результат взаимодействия образующих ее частей. Изолированная система – система, не обменивающаяся со средой ни веществом, ни энергией. Закрытая система обменивается со средой энергией, но не обменивается веществом. Если закрытая система получает энергию, она положительна, если отдает – отрицательна. Открытая система обменивается со средой веществом и энергией. Закрытые и изолированные системы создаются человеком с определенными целями. Химические реакции, как правило проводят в закрытых системах. Состояние системы характеризуется параметрами состояния: давления, температуры, объема и компонентный состав, т.е. какие вещества и в каком количестве в системе присутствуют. Внутренняя энергия системы (U) – это общий запас энергии системы, включающий энергию поступательного и вращательного движения молекулы, энергию внутримолекулярных колебаний атома, энергию движения электронов в атоме, внутриядерную энергию, т. е. все виды энергии кроме кинетической энергии движения системы как целого и его потенциальной энергии. Внутренняя энергия является функцией состояния системы, U(P,V,T, Процесс в ходе которого меняется хотя бы один из параметров называется термодинамическим процессом. И в ходе такого процесса изменяться внутренняя энергия системы P2,V1,T1,
Изменение внутренней энергии не зависит от пути перехода системы из первого состояния во второе, а зависит только от начального (U1) и конечного (U2) значения внутренней энергии. Если закрытая система переходит из состояния 1 в состояние 2, она обменивается с внешней средой теплотой и механической энергией, затрачиваемой механической работой. Закон сохранения энергии: теплота, подводимая к системе, затрачивается на изменение внутренней энергии и совершение работы, где работа, действующая против всех сил действующих на систему.
Тепловые эффекты химических реакций. Если в закрытой термодинамической системе протекает химическая реакция Тепловые эффекты реакции при постоянном объеме (Qv) V=V2=const;
Если Если Рекации при V=const могут идти в следующих случаях: 1. в закрытом сосуде (тепловая бомба); 2. между твердыми телами и жидкостями без выделения газа; 3. между газами, если число молекул остается постоянным. Реакции при P=const (тепловой эффект Qp):
Сумма внутренней энергии и произведение объёма на внешнее давление называется энтальпией (
Стандартное состояние. Чтобы сравнивать между собой тепловые эффекты различных реакций необходимо стандартизировать условия, в которых эти реакции протекают (исходные вещества взяты в стехиометрических отношениях). Состояние каждого вещества создается как стандартное состояние. Это физическое состояние, в котором вещество более устойчиво, при P0=101кПа=1атм. и T=298К=25˚С.
Термохимические уравнения – это уравнения химических реакций, в которых рядом с формулой участвующих реакций символом в скобках указывается состояние вещества (твердое – (т), кристаллическое – (к), жидкое – (ж), газообразное – (г), раствор – (р)) и после уравнения через точку с запятой указывается, величена теплового эффекта, при стандартных условиях.
В данной реакции из простых веществ Стандартная терлота образования вещества (
Стандартная теплота образования простых веществ условно принимается равной нулю. Стандартные теплоты образования сложных веществ имеются в справочной таблице.
Термохимические законы и расчёты по ним: 1. Закон Гесса. Тепловой эффект реакции протекающий в несколько стадий равен сумме тепловых эффектов отдельных стадий. Окисление графита.
Следствие из закона Гесса:
То есть тепловой эффект процесса зависит только от вида исходных веществ и продуктов реакций, но не зависит от пути перехода.
Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и исходных веществ. Теплоты образования участников реакции рассчитываются в последующем выражении с учетом коэффициента уравнения реакции. Последнее выражение используется для расчета тепловых эффектов химических реакций, протекающих при стандартных условиях, с использованием справочных данных, по стандартным теплотам образования участников реакций. 2. Закон Лавуазье-Лапласа. Теплота образования вещества численно равна теплоте разложения вещества с противоположным знаком.
Направленность химических реакций. aA+bB=cC+dD Всякая химическая реакция обратима, т.е. может протекать как в прямом, так и в обратном направлении. Поэтому в реакционной смеси всегда присутствуют как исходные вещества, так и продукты реакции. Но отношение будет зависеть от условий, в которых находятся реагирующие вещества. Все реакции обратимы, но в определенных условиях они могут протекать в определенном направлении. Термодинамика позволяет определить направление протекания данной реакции при данных условиях (при t=const и P=const). Самопроизвольно протекают процессы связанные с уменьшением свободной энергии системы. Исходя из этого, самопроизвольно могут протекать реакции в ходе, которых уменьшается свободная энергия системы. При экзотермической реакции теплосодержание уменьшается такие реакции должны идти самопроизвольно (
Следовательно, принцип Бертло-Томсона не распространяется на все реакции. Это объясняется тем, что изменение свободной системы связано не только с изменением ее теплосодержанием, но и с изменением энтропии. Процессы могут протекать и без изменения внутренней энергии Энтропия (S, Дж/К) – это термохимическая функция, мера беспорядка системы, функция вероятности состояния системы. Таким образом, самопроизвольно идут процессы, в ходе которых энтропия увеличивается, то есть растет хаотизация. Обратный процесс требует затраты энергии.
Самопроизвольно может протекать расширение газа в пустоту или в вакуум и процессы смешения.
протекания процесса.
Изменение энтропии не зависит от способа перехода системы из начального состояния в конечное состояние, а определяется лишь исходным и конечным состоянием реагирующих веществ. И если Энтропия вещества зависит от его физического состояния и при переходе из кристаллического в жидкое и газообразное энтропия будет увеличиваться. Энтропия пропорциональна температуре. Изобарно-изотермический потенциал системы – это величина свободной энергии системы при постоянном давлении и температуре, при стандартных условиях, она обозначается G0. В ходе химической реакции имеет место изменение изобарно-термического потенциала.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 619; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.170.80 (0.009 с.) |


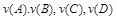 ). Можно охарактеризовать состояние системы параметрами (P1,V1,T1,
). Можно охарактеризовать состояние системы параметрами (P1,V1,T1,  ).
). .
.

 , то в начальном состоянии у нас имеется а моль и b моль вещества A, B, что соответствует закону внутренней энергии U
, то в начальном состоянии у нас имеется а моль и b моль вещества A, B, что соответствует закону внутренней энергии U  , при P, T=const; в конечном состоянии в системе при данных T и P присутствует c, d моль веществ C и D – это соответствует запасу внутренней энергии U
, при P, T=const; в конечном состоянии в системе при данных T и P присутствует c, d моль веществ C и D – это соответствует запасу внутренней энергии U  , при P, T=const. Тепловой эффект реакции при температуре Т – это тепловая энергия Q, которая выделяется или поглощается при взаимной исходности веществ, причем реагенты и продукты реакций находятся при одной и той же температуре.
, при P, T=const. Тепловой эффект реакции при температуре Т – это тепловая энергия Q, которая выделяется или поглощается при взаимной исходности веществ, причем реагенты и продукты реакций находятся при одной и той же температуре. V=0, то Qv=
V=0, то Qv= 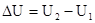 ;
;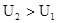 , то Qv>0
, то Qv>0  тепло поглощается (эндотермическая реакция).
тепло поглощается (эндотермическая реакция).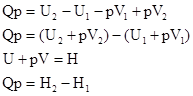
 - энтальпия теплосодержания системы – это сумма внутренней энергии и произведения объема системы на внешнее давление.
- энтальпия теплосодержания системы – это сумма внутренней энергии и произведения объема системы на внешнее давление. - изменение энтальпии (изменение внутреннего содержания системы).
- изменение энтальпии (изменение внутреннего содержания системы).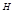 ), имеет размерность энергии и обозначается теплосодержанием системы. Энтальпия, как и внутренняя энергия, является функцией состояния. Её внутреннее значение
), имеет размерность энергии и обозначается теплосодержанием системы. Энтальпия, как и внутренняя энергия, является функцией состояния. Её внутреннее значение 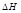 (изменение энтальпии) в ходе термодинамического процесса или входе химической реакции.
(изменение энтальпии) в ходе термодинамического процесса или входе химической реакции.
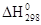 - тепловой эффект реакции протекающий при стандартных условиях.
- тепловой эффект реакции протекающий при стандартных условиях.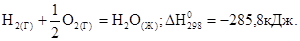
 и
и  образуется сложное вещество
образуется сложное вещество  тепловой эффект таких реакций называется теплотой образования вещества.
тепловой эффект таких реакций называется теплотой образования вещества.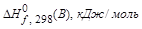 ) – это тепловой эффект образования 1 моль вещества из простых веществ, находящихся в стандартном состоянии.
) – это тепловой эффект образования 1 моль вещества из простых веществ, находящихся в стандартном состоянии. .
.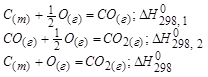

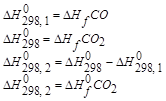



 ), однако данный критерий не является единственным. Изменение свободной энергии определяется также величиной ещё одной термодинамической функции – энтропией. Можно привести пример реакций, которые являются экзотермическими, но самопроизвольно не протекают.
), однако данный критерий не является единственным. Изменение свободной энергии определяется также величиной ещё одной термодинамической функции – энтропией. Можно привести пример реакций, которые являются экзотермическими, но самопроизвольно не протекают.
 и без изменения теплосодержания
и без изменения теплосодержания 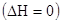 .
.
 Критерии самопроизвольного
Критерии самопроизвольного (В), Дж/моль*К) предназначена для сопоставления и определения энтропии в химической реакции. Можно оценить энтропию для 1 моль любого вещества для стандартных условий. Для энтропии соблюдаются следствия из закона Гесса.
(В), Дж/моль*К) предназначена для сопоставления и определения энтропии в химической реакции. Можно оценить энтропию для 1 моль любого вещества для стандартных условий. Для энтропии соблюдаются следствия из закона Гесса. - изменение энтропии при стандартных условиях в ходе химической реакции.
- изменение энтропии при стандартных условиях в ходе химической реакции.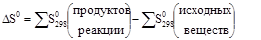
 , то реакции идут самопроизвольно при условии, что
, то реакции идут самопроизвольно при условии, что  .
.
 - состояние равновесия, т. е. прямой и обратный процесс протекает с одинаковыми скоростями и оба направления равновероятны. При
- состояние равновесия, т. е. прямой и обратный процесс протекает с одинаковыми скоростями и оба направления равновероятны. При 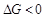 она может при данных температуре и давления протекать самопроизвольно, обратная реакция не возможна.
она может при данных температуре и давления протекать самопроизвольно, обратная реакция не возможна.


