
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловой эффект химических реакций.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Введение Методические указания к лабораторным работам предназначены для студентов инженерно-технических (нехимических) специальностей. Для обеспечения безопасных условий труда в лаборатории в первую очередь необходимо, чтобы внимание студентов было полностью сосредоточено на выполняемой ими работе. Все операции должны выполняться тщательно и аккуратно, поэтому прежде чем приступить к работе, студенты должны изучить приведенные в настоящем руководстве правила по технике безопасности. В каждой лаборатории имеются инструкции по технике безопасности, изучив которые и получив дополнительный инструктаж от преподавателя, студенты приступают к выполнению лабораторных работ. В процессе работы необходимо использовать только чистую химическую посуду, так как даже малейшие примеси могут привести не только к срыву опыта, но и к несчастному случаю. Рабочий стол следует содержать в чистоте и не в коем случае не загромождать посторонними предметами. Студенты должны научиться ясно и точно описывать проведенные ими опыты. Для этого по каждой работе, выполненной в лаборатории, они составляют отчет. Описание лабораторной работы ведется в процессе ее выполнения или сразу же после окончания. В отчете должно быть отражено, что происходило в ходе реакции: появление или исчезновение окраски или осадка, выделение газа, самопроизвольное повышение температуры и т.д., как контролировалось течение реакции.
Лабораторная работа № 1. Тепловой эффект химических реакций. 1. ЦЕЛЬ РАБОТЫ: Определение опытным путем энтальпии растворения вещества. 2. РАБОЧЕЕ ЗАДАНИЕ: Определить экспериментально изменение температуры калориметрической жидкости в зависимости от времени. Рассчитать тепловой эффект реакции. 3. ОБЩИЕ СВЕДЕНИЯ: Все процессы, имеющие значение в химии - химические реакции, реакции растворения, реакции диссоциации, фазовые переходы, кристаллизации, сопровождаются различными энергетическими эффектами. Превращение энергии из одной формы в другую, происходящее при химических реакциях, изучает химическая термодинамика. Количество теплоты, выделяющиеся или поглощающееся при химической реакции называется тепловым эффектом реакции. Тепловой эффект химической реакции, протекающий при постоянном давлении равен изменению энтальпии Δ Н. В термохимии приняты следующие знаки: если система выделяет тепло в окружающую среду, то реакция называется экзотермической, величина Н имеет знак «-» (Δ Н<0). Если система поглощает тепло из окружающей среды реакция называется эндотермической и величина Н имеет знак «+» (Δ Н>0).
Основным законом термохимии является закон Гесса: «Тепловой эффект химической реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от промежуточных стадий процесса». Для химический расчетов важна энтальпия образования сложного вещества. Если исходные вещества и продукты реакции находятся в стандартных условиях (Т=298 К и р=101,3 кПа), то энтальпия образования 1 моль вещества называется стандартной энтальпией образования. Она обозначается Нº298 . Стандартные энтальпии простых веществ принимаются равными нулю. Значения стандартных энтальпий образования приводятся в таблице справочной литературы. Следствием закона Гесса является соотношение:
продуктов исходных веществ
Тепловые эффекты, сопровождающие химические реакции, измеряют в специальных приборах калориметрах. ЭНТРОПИЯ И СВОБОДНАЯ ЭНЕРГИЯ СИСТЕМЫ. ОБЪЕКТ ИССЛЕДОВАНИЯ. Определение теплового эффекта реакции. 5. КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. В чем, по вашему мнению, может быть причина расхождений между результатами ваших измерений и расчетов? 2. При каких химических реакциях измеренная энтальпия реакции равна энергии этой реакции? 3.Вычислить стандартную энтальпию образования сероуглерода, по реакции сгорания 38г. сероуглерода: CS2+3O2=2SO2+CO2 ΔH= - 1103 кДж? 4.Какие термодинамические функции вы знаете? РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ ЭКСПЕРИМЕНТА. 1. График построить на миллиметровой бумаге. 2. Причиной высокого значения относительной ошибки результатов опыта является несовершенство упрощенного калориметра. СОСТАВЛЕНИЕ ОТЧЕТА. 1.Цель работы, задание 2. Порядок проведения опыт 3. Задание. 4. Таблица экспериментальных данных. 5. Рисунок калориметра (рис.1) 6. График с определением ΔТ на миллиметровой бумаге, размером 15на15 см включить в отчет (рис.2).
7. Описание опыта. 8..Расчет ΔН и относительной погрешности η в %. 9. Вывод 10. Ответы на контрольные вопросы.
Рис. 1 Калориметр. 1. Внешний стакан 2. Крышка 3. Теплоизоляционная прокладка 4. Калориметрическая жидкость 5. Внутренний калориметрический стакан 6. Термометр 7. Отверстия для внесения испытуемых веществ
рис. 2 Графическое определение ΔТ.
СПИСОК ЛИТЕРАТУРЫ. 1..Глинка Н.Л. Задачи и упражнения по общей химии. Москва: Интеграл – пресс, 2001 – 2006,66 -79 с. 2. Коровин Н. В. Общая химия. – М.: Высшая школа, 2004,116 -141 с. 3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженерно- технических (нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1. 4. Белозерова Т.И. Термохимические расчеты. Химическое равновесие. Правило Ле Шателье. Методические указания к практическим работам. Севмашвтуз, 2006, 14с. РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ. 1. Соблюдайте осторожность при работе с термометром и с раствором щелочи. 2 В случае попадания щелочи на одежду следует смыть её водой, а затем нейтрализовать раствором уксусной кислоты с массовой долей 5%. 3.При попадании на лицо, глаза и на руки химических реактивов следует промыть пораженный участок большим количеством воды. 4.Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 2. ОБЩИЕ СВЕДЕНИЯ Примеры решения задач. Пример 1: Как изменится скорость реакции протекающей в закрытом сосуде, если увеличить давление в 4 раза? 2NO(г.)+О2(г.)=2NO2 Решение: увеличить давление в 4 раза означает увеличить и концентрацию газов во столько же раз. 1. Определяем скорость реакции до повышения давления. V1 =K*C2NO*CO2 2. Определяем скорость реакции после повышения давления. V2=K*(4CNO)2*(4CO2)=64K*C2NO*CO2 3. Определяем, во сколько раз возросла скорость реакции V1/V2=64*K*C2NO*CO2 / K*C2NO*CO2 Ответ: скорость реакции возросла в 64 раза. Пример 2: Во сколько раз возрастёт скорость реакции при повышении температуры с 20 С˚ до 50 С˚? Температурный коэффициент равен 3. Решение: По правилу Вант – Гоффа:
По условию требуется определить
Ответ: скорость реакции возросла в 27 раз. ОБЪЕКТ ИССЛЕДОВАНИЯ. Зависимость скорости химической реакции от концентрации реагирующих веществ должна быть показана на основании измерения времени от момента сливания растворов до начала реакции, определяемой по помутнению раствора, обусловленному выделением свободной серы. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1.Что называется скоростью химической реакции? 2. Какова зависимость скорости реакции от концентрации реагирующих веществ? 3. Как называется величина К? Каков её физический смысл? 4. Зависит ли коэффициент К от изменения температуры? 5. Как влияет температура на скорость химической реакции? 6. Как влияет давление на скорость химической реакции между газообразными веществами? РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ ЭКСПЕРИМЕНТА. При проведении лабораторного опыта необходимо каждый раствор отмерять своим цилиндром. Каждый опыт проводить в новой пробирке. При попадании на лицо, в глаза, на руки химических реактивов следует смыть немедленно водой и хорошо промыть пораженный участок большим количеством воды. СОСТАВЛЕНИЕ ОТЧЕТА. 1. Цель работы, рабочее задание.
2. Химическая реакция, таблица, график. 3. Вывод о влиянии концентрации на скорость химической реакции. 4. Ответы на контрольные вопросы. СПИСОК ЛИТЕРАТУРЫ. 1.Глинка Н.Л. Задачи и упражнения по общей химии. Москва: Интеграл – пресс, 2001 – 2006,79-93 с. 2. Коровин Н. В. Общая химия. – М.: Высшая школа, 2004, 142-158 с. 3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженерно- технических (нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1. 4. Белозерова Т.И. Термохимические расчеты. Химическое равновесие. Правило Ле Шателье. Методические указания к практическим работам. Севмашвтуз, 2006, 14с. РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ. 1. Соблюдайте осторожность при работе с термометром и с раствором щелочи. 2 В случае попадания щелочи на одежду следует смыть её водой, а затем нейтрализовать раствором уксусной кислоты с массовой долей 5%. 3.При попадании на лицо, глаза и на руки химических реактивов следует промыть пораженный участок большим количеством воды. 4.Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 3. ОБЩИЕ СВЕДЕНИЯ Молярная концентрация. Молярная концентрация – это отношение количества вещества v(A) к объему раствора V(р-ра). С(А)= v (A)/ V(р-ра) (моль/л) (4) Раствор с молярной концентрацией K2SO4 C(K2SO4)=1моль/л может быть обозначен как 1 М K2SO4 – одно молярный раствор сульфата калия. v (A)=m(A)/M(A) (5) объединяя (6) и (7) получаем: С(А)=m(A)/M(A)*V (6) Где m(A) – масса вещества (г), М(А) – молярная масса вещества (г/моль), V – объем раствора (л). Пример 5. Определить молярную концентрацию раствора KOH, в 50 мл которого содержится 5,6 г вещества. CKOH=m(KOH)/M(KOH)=5,6*1000/56*50=2 моль/л или 2 М KOH ОБЪЕКТ ИССЛЕДОВАНИЯ. При проведении лабораторной работы необходимо определить плотность приготовленного раствора. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1.В 110г водного раствора содержится 56г КОН. Какова массовая доля КОН в растворе? 2.В 910г Н2О растворено 309г NaOH, плотность раствора ρ=1,3 г/мл. Найдите: а) массовую долю NaOH б) молярную концентрацию 3.Сколько кг растворителя нужно добавить к 1л раствора с молярной концентрацией См=4 моль/л, чтобы получить раствор См=0,2 моль/л. РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ ЭКСПЕРИМЕНТА. 1. При проведении опыта ареометр подбирать с учетом теоретически рассчитанной плотности. 2. После измерения плотности, ареометр промыть, протереть СОСТАВЛЕНИЕ ОТЧЕТА. 1. Порядок проведения опыта. 2. Расчеты. 3. Ответы на контрольные вопросы. 4. Вывод 5.Решить предложенный вариант
СПИСОК ЛИТЕРАТУРЫ. 1.Глинка Н.Л. Задачи и упражнения по общей химии. Москва: Интеграл – пресс, 2001 – 2006,95 -102 с. 2. Коровин Н. В. Общая химия. – М.: Высшая школа, 2004, 204 -212 с. 3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженерно- технических (нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1. РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ. 1. Соблюдайте осторожность при работе с ареометром. 2 Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 4. Электролиз растворов 1.ЦЕЛЬ РАБОТЫ: Изучить электродные процессы при электролизе растворов. 2. РАБОЧЕЕ ЗАДАНИЕ: 1. Взвесить массу катода до электролиза. 2.Провести процесс электролиза. 3. Взвесить массу катода после электролиза. 4. Рассчитать выход по току. 5.Ответить на контрольные вопросы. ОБЩИЕ СВЕДЕНИЯ. Окислительно-восстановительная реакция, протекающая в растворе или расплаве электролита у электродов при пропускании постоянного электрического тока, называется электролизом. Электролиз осуществляется в электролизерах. Основным конструкционным элементом являются электроды, соединенные с полюсами источника постоянного тока. Электрод, присоединенный к отрицательному полюсу источника тока, называется катодом, положительный электрод - анодом. На катоде в процессе электролиза всегда происходит восстановление катионов из объема электролита. На аноде происходит отдача электронов, т.е. реакция окисления. В растворах и расплавах различных электролитов имеются разноименные по знаку ионы, т.е. катионы и анионы, которые находятся в хаотическом движении. Но если в такой расплав электролита, например, расплав хлорида натрия NaCl, опустить электроды и пропустить постоянный электрический ток, то катионы Na+ будут двигаться к катоду, а анионы Сl - к аноду. На катоде электролизера происходит процесс восстановления катионов электронами внешнего источника тока: Na+ + e= Na° Катион натрия Металлический натрий На аноде идет процесс окисления аниона хлора, причем, отрыв избыточных электронов от С1 - осуществляется за счет энергии внешнего источника тока: 2С1 - - 2е = С12° Анион хлора Молекулярный хлор Суммарное уравнение электролиза расплава хлорида натрия: 2NaCl → 2Na + + 2С1 - → 2Na ° + С12° Если электролизу подвергается расплав, который содержит несколько различных катионов металлов, то в этом случае последовательность восстановления определяется электродными потенциалами. В первую очередь восстанавливаются катионы металлов, обладающих большим значением электродного потенциала. Более сложные процессы электролиза протекают в водных растворах электролитов. С учетом ряда стандартных потенциалов металлов возможны три случая протекания восстановительного процесса на катоде в водных растворах (процессы на катоде не зависят от материала катода): 1. Катионы металлов, стандартный электродный потенциал которых больше, чем -0,413В (от Ni2+ до Pt4+), при электролизе практически полностью восстанавливаются на катоде. Меn+ +n*е→Меo 2. Катионы металлов, с малой величиной стандартного электродного
2Н2О + 2е → Н2 + 2ОН - 3. Катионы металлов, стандартный ионный потенциал которых Для определения порядка протекания окислительно-восстановительных процессов на электродах при электролизе водных растворов можно руководствоваться правилами таблицы 1. Таблица 1 Решение типовых задач Задача 1. Написать уравнение электролиза раствора KCl, если анод нерастворимый.
Катод (-) Анод (+) 2H2O+2e↔ H2↑+2OH 2Cl-2e↔Cl2 Суммарное ионное уравнение: 2Н2О + 2С1 → Н2↑ + С12↑ + 2ОН- Суммарное молекулярное уравнение: 2КС1 + 2Н2О→ 2Н2↑ + С2↑+ 2КОН Вторичный продукт электролиза Задача 2. Написать уравнение реакции электролиза водного раствора AgNO3, если а) анод нерастворимый; б) анод растворимый, серебряный. Решение: а) анод нерастворимый AgNO3↔ Ag + + NO3- катод(-)…………………………………….анод(+)
Суммарное уравнение процессов: 4AgNO3 + 2H2O→4Ag + О2+4 HNO 3 Вторичный продукт электролиза б) анод растворимый, серебряный
Суммарное уравнение электролиза с растворимым анодом написать нельзя. Расчет количества веществ, разложенных или образовавшихся в процессе электролиза, производится по закону Фарадея. Теоретически массы веществ, испытавших изменение при электролизе, определяются
Q – количество прошедшего электричества m – масса вещества, г.
J – сила тока, А
Пример: Сколько меди выделяется при пропускании через раствор ее соли тока силой 6А, в течение 1 часа, если выход по току составляет 98%? m(Си)факт = m(Си)теор*0,98 = Следовательно, на катоде выделится 7 грамм меди. ОБЪЕКТ ИССЛЕДОВАНИЯ. Лабораторная установка для проведения процесса электролиза с растворимым медным анодом. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1. В каких случаях образуются вторичные продукты при электролизе? 2. В какой последовательности и выделяются на катоде металлы при электролизе раствора, содержащего ионы Ni2+, Cr2+,Fe3+? 3. Какой силы должен быть ток, чтобы при пропускании его через расплав MgSO4 выделить на катоде 6 г. магния за 10 часов? Написать уравнения электродных процессов. 4. Через последовательно соединенные электролитические ванны с платиновыми электродами пропустили ток. В первой ванне раствор сульфата натрия, во второй-раствор нитрата серебра, а в третьей - раствор соляной кислоты. Какие продукты выделились на электродах во всех трех ваннах и сколько их получилось по массе, если в первой ванне выделится на катоде 1 мг. водорода? 5. Через водный раствор NaCl (электроды угольные) пропускали ток сначала при перемешивании раствора, а затем без перемешивания, отделив в последнем вторичные продукты. Написать уравнения электродных процессов для двух случаев. РЕКОМЕНДАЦИИ ПО ПЛАНИРОВАНИЮ И ПРОВЕДЕНИЮ ЭКСПЕРИМЕНТА. При проведении эксперимента следить за показаниями приборов. СОСТАВЛЕНИЕ ОТЧЕТА. 1. Порядок проведения опыта. 2. Расчеты. 3. Ответы на контрольные вопросы. 4. Вывод 5.Решить предложенный вариант СПИСОК ЛИТЕРАТУРЫ. 1.Глинка Н.Л. Задачи и упражнения по общей химии. Москва: Интеграл – пресс, 2001 – 2006,95 -102 с. 2. Коровин Н. В. Общая химия. – М.: Высшая школа, 2004, 204 -212 с. 3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженерно- технических (нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1. РЕКОМЕНДАЦИИ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ. 1. Соблюдайте осторожность при работе с ареометром. 2 Не оставляйте на рабочих местах грязную посуду. Лабораторная работа № 5. ОБЪЕКТ ИССЛЕДОВАНИЯ. Электрохимическая коррозия металлов и методы защиты металлов от коррозии. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1.Составить схему коррозийного элемента и написать уравнения реакции, протекающих при наличии повреждений свинцовой оболочки стального кабеля подводной линии связи. 2. Для защиты контактов из серебра и других чувствительных к сероводороду материалов применяют гальванические покрытия из золота. Какие процессы будут протекать на серебряных контактах плат при нарушении сплошности покрытия из золота во влажной атмосфере? 3. Какие покрытия на металлах относятся к неметаллическим неорганическим? 4. Какие вещества называют ингибиторами коррозии? 5. Приведите примеры использования контактных и летучих ингибиторов атмосферной коррозии. 6. Можно ли использовать смесь нитрата натрия со щёлочью для защиты внутренних поверхностей трубопроводных систем парогенераторов? Лабораторная работа №6 Структурные формулы Структурные формулы - это порядок расположения атомов в молекуле в одной плоскости, (на самом деле атомы в молекулах располагаются в разных плоскостях). Структурные формулы оксидов: +5 -2 Р2О5
(чёрточка указывает на единицу степени окисления). У фосфора их 5, у кислорода-2. Структурные формулы гидрооксидов: NaOH Al(OH)3
Na –O – H O – H │ H – O – Al – O – H Атомы водорода соединяются с атомом серы только через атомы кислорода
Структурные формулы солей: Для составления нужно иметь в виду структуру кислотного остатка кислоты, образующей соль и к нему присоединять атомы металла, например: К3РО4-соль ортофосфорной кислоты, структура соли:
K – O – P = O
Основная соль (CuOH)2SO3 – сульфит гидроксомеди (II) Структура кислотного остатка:
– O а соли:
H – O – Cu – O Bi(OH)2 NO3 - нитрат дигидроксовисмута (III) O
H – O || O
Основнымиоксидами называются такие, которые при взаимодействии с кислотами образуют соль и воду. Соединение этих оксидов с водой относят к классу оснований (например, оксиду Na2O соответствует основание NaOH). Кислотнымиоксидами называются такие, которые при взаимодействии с основаниями образуют соль и воду. Соединение этих оксидов с водой относят к классу кислот (например, оксиду Р2О5 соответствует кислота Н3РО4, а оксиду Сl2О7 – кислота НСlО4). Камфотернымоксидами называются такие, которые при взаимодействии с кислотами и основаниями с образованием соли и воды. Соединение этих оксидов с водой могут иметь как кислотные, так и основные свойства (например, амфотерному оксиду ZnO соответствует основание Zn(OH)2 и кислота H2ZnO2). Характерной особенностью оксидов является способность их к образованию солей. Поэтому такие оксиды относятся к солеобразующим. Наряду с солеобразующими существуют и несолеобразующие, или безразличные, оксиды, которые не образуют солей. Примером могут служить CO, N2O, NO. Химические свойства оксидов Таблица 1
Основания (гидроксиды) -сложные вещества, в состав которых входят атомы металлов (катионов) и одна или несколько гидроксильных групп-Ме(ОН)n. Число гидроксогрупп в молекуле основания зависит от валентности металла и обычно равно ей. Например, Сu(ОН)2-гидроксид меди (II), Fe(ОН)3-гидроксид железа (III). Химические свойства кислот 1. Водные растворы кислот взаимодействуют с металлами, стоящими в ряду напряжения до водорода, с образованием соли выделения водорода (исключение НNО3): Zn+2HCl → ZnCl2+H2↑ 2. Кислоты взаимодействуют с основными оксидами и основаниями с образованием соли и воды: CuO+ H2SO4 → CuSO4+H2O NaOH+HCl → NaCl+ H2O (реакция нейтрализации) 3. Кислоты взаимодействуют с амфотерными оксидами с образованием соли и воды: Cr2O3+6HCl → 2CrCl3 +3H2O 4. При нагревании некоторые кислоты разлагаются. Как правило, образуется кислотный оксид и вода: H2SiO3 → SiO2+H2O Соли -это продукты полного или частичного замещения атомов водорода в кислоте на атомы металла или гидроксогрупп в основании на кислотные остатки. В случае полного замещения образуются средние (нормальные соли). В случае частичного замещения получаются кислые и основные соли. Средние соли образуются при взаимодействии кислот с основаниями, когда кол-во взятых веществ достаточно для полного замещения атомов водорода в кислоте на атом металлов или гидроксильных групп в основании на кислотный остаток: Al(OH)3+3HCl → AlCl3+ 3H2O хлорид алюминия Кислые соли образуются многоосновными кислотами при взаимодействии кислот с основаниями в тех случаях, когда кол-во взятого основания недостаточно для образования средней соли, например:
H2SO4+NaOH → NaHSO4+ H2O гидросульфат натрия Как видно из реакции, гидроксида натрия взято вдвое меньше, чем это требовалось бы для полного замещения атомов водорода на атом металла. При добавлении к раствору кислой соли получается кислая соль: NaHSO4+NaOH → Na2SO4+ H2O Основные соли могут быть образованны только многокислотными основаниями и в тех случаях, когда взятого кол-ва кислоты недостаточно для образования средней соли, например: Fe(OH)3+H2SO4 → FeOHSO4+2H2O Гидросульфат железа (III) илисульфат гидроксожелеза (III) При добавлении к основной соли кислоты можно получить среднюю, например: 2FeOHSO4+H2SO4 → Fe2(SO4)3+2H2O. сульфат железа (III) Двойные соли – продукты полного замещения водорода кислоты двумя металлами. KAl(SO4)2 - сульфат калия-алюминия NH4Fe(SO4)2 - сульфат аммония-железа (II). Комплексные соли - вещества, содержащие сложный комплексный ион, способный к самостоятельному существованию. [Cu (NН3)4] SO4 сульфат тетроаммин меди (II) K3 [ Fe(CN)6] гексацианоферрат калия (III) K4 [Fe(CN)6] гексацианоферрат калия (II) В таблице 3 приведены традиционные названия (номенклатура) анионов наиболее часто встречающихся кислот. ОБЪЕКТ ИССЛЕДОВАНИЯ. Основные классы неорганических соединений: оксиды, кислоты, соли. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1. Написать формулы и определить степень окисленности каждого элемента в соединениях: сульфат калия, гидрофосфат железа, нитрат кальция, оксид марганца ( VI), сульфат гидроксокобальта. 2. Дать определение понятиям: оксид, гидроксид, соль. Привести примеры. 3. Дописать уравнения реакций (получить среднюю, кислую, основную соли): KOH+H2CO3→ Zn(OH)2+HCl→ 4. Доказать амфотерный характер гидроксида, рассматривая его взаимодействие с кислотой и щелочью. VII. Составление отчета 1. Цель работы, задание 2. Порядок проведения опытов 3. Химические реакции. 4. Ответы на контрольные вопросы. 5. Вывод. 6. Решить предложенный вариант Вариант 1 1. Дайте определение понятию «оксид». Назовите группы оксидов. Приведите примеры. 2. Укажите валентность кислотных остатков, входящих в состав солей, формулы которых MgBr2; Ca3(PO4)2; KMnO4; NaCO3; CuSO4; Fe(NO3)3. 3. Написать структурные формулы веществ: Al(OH)3; Ca(NO3)2. 4. Напишите формулы кислотных оксидов, соответствующих указанным кислотам: угольная, серная азотная. 5. Получить кислую и нормальную (среднюю) соли при взаимодействии угольной кислоты с гидроксидом кальция. Написать уравнения реакций. Назвать получившиеся соли. Вариант 2 1. Дайте определение понятию «гидроксид». Назовите группы гидроксидов. Приведите примеры. 2. Из следующего перечня солей, формулы которых приведены ниже,, выберите отдельно а) основные соли; б) средние (нормальные) соли; в) кислые соли: NaHCO3; K2SO4; Cu2(OH)2CO3; CaCO3; BaCl2; Mg(OH)Cl. 3. Напишите структурные формулы гидроксидов следующих металлов: лития (I), свинца (II), марганца (IV), хрома (III). От чего зависит количество гидроксильных групп в основаниях? 4. Напишите формулы ниже перечисленных кислот и дайте название соответствующим солям: азотистая, сернистая, хромовая. 5. Получить основную и нормальную (среднюю) соли при взаимодействии серной кислоты с гидроксидом кальция. Вариант 3 1. Дайте определение понятию «соль». Назовите группы солей. Приведите примеры. 2. Напишите формулы оксидов K, Ba, Al, Si, P, S, N, зная, что валентность соответствует номеру группы периодической системы. 3. Приведите по одной формуле кислот разной основности. Напишите по одной формуле сильной и слабой кислот. Дайте названия. 4. Назвать вещества: 5. Написать структурные формулы указанных веществ: NaHSO4; H3PO4. Определить степени окисления всех элементов в соединениях. Вариант 4 1. Какова валентность марганца в оксидах, формулы которых Mn2O3; MnO; MnO2; Mn2O7; MnO3. К какой группе оксидов относятся примеры приведенных веществ? Ответ обосновать. 2. Напишите формулы следующих солей: сульфата калия, нитрата бария, карбоната натрия, хлорида меди, сульфита натрия, иодида калия. 3. Напишите структурные формулы следующих веществ: Al2O3, Ba(OH)2, HNO2. 4. Определить степени окисления всех элементов в соединениях: KMnO4; H2Cr2O7; H2SO4; Na2O; P2O3; SiO2. 5. Получить основную и нормальную (среднюю) соли при взаимодействии азотной кислоты и гидроксида железа (II). Назвать получившиеся соли. Вариант 5 1. Напишите формулы по названиям приведенных гидроксидов: гидроксид натрия, гидроксид кальция, гидроксид бария, гидроксид алюминия, гидроксид хрома, гидроксид цинка. Назовите среди указанных гидроксидов амфотерные. 2. Из перечня веществ выпишите отдельно формулы: а) оксидов; б) кислот; в)солей:
3. Написать структурные и молекулярные формулы следующих веществ: сульфат железа (III), азотная кислота, гидроксид хрома (III).
Лабораторная работа № 7. Очистка сточных вод. 1.ЦЕЛЬ РАБОТЫ: определение степени очистки сточных вод гальванических цехов от ионов хрома. 2.РАБОЧЕЕ ЗАДАНИЕ: проведение очистки сточных вод от соединений хрома (VI) химическим методом осаживания. 3. ОБЩИЕ СВЕДЕНИЯ: Метод ионного обмена. Для очистки СВ этим методом используют ионообменные смолы (иониты). Органические иониты – это высокомолекулярные соединения, содержащие подвижные ионы, способные обмениваться на ионы пропускаемых через иониты растворов. При этом, если обмениваются катионы, иониты называются катионитами, а при обмене анионов – анионитами. Ионный обмен нашел применение при извлечении токсичных катионов тяжелых и цветных металлов из СВ гальванических цехов, удалении катионов кальция и магния при подготовке питательной воды для парогенераторов. Метод ионного обмена экономически целесообразен при концентрации растворенных солей до 1,5 г/л. Электродиализ. В этом методе удаление ионов из воды осуществляется под действием электрического поля и при прохождении через анионитовые и катионитовые диафрагмы (рис.2). В электродиализаторе протекает электролиз воды: на катоде: 2H2O+2e→H2+2OH- на аноде: 2H2O-4e→O2+4H+
Рис.2. Схема электродиализатора. 1. катод; 2. катионитовая диафрагма; 3. анионитовая диафрагма; 4. анод; 5. ёмкость. Электродиализ используют для удаления из СВ нитратов и фосфатов, причем, при хорошем подборе мембран можно удалить следы этих соединений. Для глубокой очистки воды электродиализ не экономичен. Химические методы предусматривают использование химических реагентов. Так, например, для очистки СВ широко применяется метод коагуляции электролитами. На границе капелек и воды существует двойной электрический слой (ДЭС), обеспечивающий отталкивание частиц друг от друга, то есть устойчивость эмульсии. Введение электролита приводит к сжатию ДЭС и способствует слипанию частиц. Комбинированные методы представляют собой сочетание различных методов, часто обеспечивающих очистку не только эмульгированных, но и других примесей. На судах для очистки СВ от нефтепродуктов в основном применяется три типа судовых сепарационных установок: 1)отстойные; 2)флотационные; 3) с предварительным и конечным отстоем. ОБЪЕКТ ИССЛЕДОВАНИЯ. Сточные воды гальванических цехов содержат триоксид хрома (CrO3), концентрация которого в отработанных растворах после хромирования составляет 100 – 250 г/л. Разбавление водой приводит к образованию хромсодержащих анионов:,. Концентрация их в СВ достигает 0,2 г/л. ПДК (предельно допустимая концентрация) составляет 0,1 мг/л (в пересчете на CrO3). Для удаления хрома из СВ гальванических участков применяют химический метод, сущность которого заключается в осаждении хрома в виде Cr(OH)3 и его фильтровании. Задача данного опыта состоит в проведении очистки СВ от соединений хрома химическим методом осаждения. В качестве восстановителя применяют соединения, содержащие ионы SO32-, HSO3-, S2- (обычно в виде солей Na2SO3, Na HSO3, Na2S). При использовании Na2SO3 протекает следующая реакция: Na2Cr2O7 + 3 Na2SO3 + 4 H2SO4 → Cr2(SO4)3 + 4 Na2<
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 612; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.40.24 (0.013 с.) |

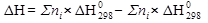



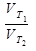 . Подставим данные в формулу:
. Подставим данные в формулу:
 Решение: KCl↔K+ +Cl-
Решение: KCl↔K+ +Cl- Ag++1e→Ag0 2H2O-4e→O2+4H+
Ag++1e→Ag0 2H2O-4e→O2+4H+ катод(-) анод(+)
катод(-) анод(+) Ag++1e→Ag Ag0-1e→Ag+
Ag++1e→Ag Ag0-1e→Ag+

 - химический эквивалент вещества, г.
- химический эквивалент вещества, г. - время электролиза, сек.
- время электролиза, сек.
 K – O
K – O K – O
K – O – O
– O S = O
S = O H – O – Cu – O
H – O – Cu – O S = O
S = O H – O ||
H – O || Bi – O – N
Bi – O – N
 ,
,  , ZnO, Al(OH)3.
, ZnO, Al(OH)3. Получить кислую и нормальную (среднюю) соли при взаимодействии сернистой кислоты с гидроксидом натрия. Написать уравнения реакций. Назвать получившиеся соли.
Получить кислую и нормальную (среднюю) соли при взаимодействии сернистой кислоты с гидроксидом натрия. Написать уравнения реакций. Назвать получившиеся соли.



